题目内容
9.向10mL浓度均为3mol•L-1的HNO3与H2SO4的混合溶液中加入1.92g铜,充分反应后,设溶液体积仍为10mL,则产生的气体在标准状况下的体积是多少升( )| A. | 0.448 L | B. | 0.224L | C. | 0.336L | D. | 无法求解 |
分析 n(H+)=3mol•L-1×0.01L×1+3mol•L-1×0.01L×2=0.09mol,n(NO3-)=3mol•L-1×0.01L=0.03mol,
n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,结合反应的离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O解答该题.
解答 解:n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,n(H+)=3mol•L-1×0.01L×1+3mol•L-1×0.01L×2=0.09mol,n(NO3-)=3mol•L-1×0.01L=0.03mol,
3Cu+8H++2NO3-=3 Cu2++2NO↑+4H2O
3 8 2
0.03 0.09 0.03
可知Cu完全反应,H+和NO3-过量,
由反应的离子方程式可知:n(NO)=$\frac{0.03mol×2}{3}$=0.02mol,
V(NO)=0.02mol×22.4L/mol=0.448L,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应、过量判断为解答的关键,侧重分析与计算能力的考查,注意结合离子反应计算,题目难度不大.

练习册系列答案
相关题目
20.下列叙述正确的是( )
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液,稀释至10倍后pH=4 | |
| C. | 用pH相等的盐酸、醋酸分别中和等体积等浓度的NaOH溶液,消耗两种酸的体积大小关系是:V(盐酸)>V(醋酸) | |
| D. | 室温下pH=3的醋酸溶液与pH=11的醋酸钠溶液中水电离出的C(H+)相等 |
17.下列各组离子在无色酸性溶液中可以大量共存的有( )
| A. | Ag+、K+、NO3-、Cl - | B. | K+、Cu2+、SO42-、HCO3- | ||
| C. | Mg2+、Cl-、SO42-、Na+ | D. | CO32-、K+、NO3-、Na+ |
4.下列说法不正确的是( )
| A. | 纯铁比生铁不易生锈 | |
| B. | 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| C. | 在海轮外壳连接锌块能保护钢制外壳不受腐蚀,此方法叫做牺牲阳极的阴极保护法 | |
| D. | 电解精炼铜,阳极质量减少64g时,电子转移不一定是2mol |
14.下列液体均处于25℃,有关叙述正确的是( )
| A. | 某物质的溶液pH<7,则该物质一定是酸 | |
| B. | 等物质的量浓度的Na2CO3溶液的碱性强于NaHCO3溶液 | |
| C. | pH=4的番茄汁中c(H+)是pH=6的牛奶中c(H+)的2倍 | |
| D. | AgCl在相同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同 |
18.下列化学用语表示正确的是( )
| A. | 甲烷的结构式:CH4 | |
| B. | 硫离子的结构示意图: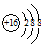 | |
| C. | Na2S的电子式: | |
| D. | 硫酸钠电离方程式:Na2SO4=Na2++SO42- |
19.CPAE是蜂胶的主要活性成分,由咖啡酸合成CPAE路线如图:下列说法正确的是( )
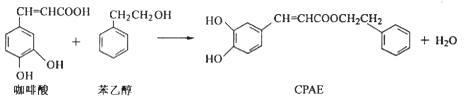

| A. | 苯乙醇属于芳香醇,它与邻甲基苯酚互为同系物 | |
| B. | 用FeCl3溶液可以检测上述反应中是否有CPAE生成 | |
| C. | 1 mol CPAE最多可与含3 molNaOH的溶液发生反应 | |
| D. | 咖啡酸、苯乙醇及CPAE都能发生取代、加成和消去反应 |
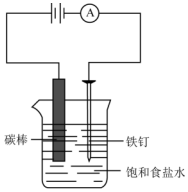 如图所示,回答下列问题:
如图所示,回答下列问题: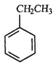 (g)+CO2(g)?
(g)+CO2(g)?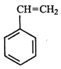 (g)=CO(g)+H2O(g)△H,其中乙苯在CO2气氛中的反应可分两步进行
(g)=CO(g)+H2O(g)△H,其中乙苯在CO2气氛中的反应可分两步进行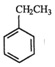 (g)?
(g)?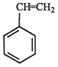 (g)+H2(g)△H1=-125KJ/mol
(g)+H2(g)△H1=-125KJ/mol .
.