题目内容
已知450℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数K=100,由此推测在450℃时,反应HI(g)?
H2(g)+
I2(g)的平衡常数为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、0.01 | B、50 |
| C、100 | D、0.1 |
考点:化学平衡的计算
专题:化学平衡专题
分析:化学平衡常数指,一定温度下,可逆达到平衡,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,故对于同一可逆反应,相同温度下,正、逆两个方向的平衡常数互为倒数,同一可逆反应,平衡常数与系数成对应幂次方关系.
解答:
解:对于同一可逆反应,相同温度下,正、逆两个方向的平衡常数互为倒数,已知450℃时,反应H2(g)+I2(g)?2HI(g)的K=100,则在450℃时,反应 2HI(g)?H2(g)+I2(g)的化学平衡常数为
=0.01,所以在450℃时,反应HI(g)?
H2(g)+
I2(g)的平衡常数
=0.1.
故选D.
| 1 |
| 100 |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.01 |
故选D.
点评:本题考查平衡常数的书写、计算等,比较基础,掌握平衡常数的书写与意义即可解答.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
下列微粒互称为同位素的是( )
| A、126C和146C |
| B、O2和O3 |
| C、4019K和4020Ca |
| D、11H+ 和11H |
一定温度下,在固定容积、体积为2L的密闭容器中充入1molN2和3molH2发生反应,当反应进行到10s末时达到平衡,此时容器中c(NH3)=0.15mol?L-1.下列有关判断不正确的是( )
| A、反应达平衡时N2的转化率为7.5% |
| B、反应进行到10s末时,H2的平均反应速率是0.0225mol?(L?s)-1 |
| C、该反应达到平衡时的标志是容器中气体压强不再改变 |
| D、该反应达到平衡时的标志是容器中气体密度不再改变 |
下列关于有机物的说法错误的是( )
A、由CH2=CHCOOCH3合成的聚合物为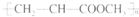 |
| B、溴乙烷与NaOH乙醇溶液共热生成乙烯 |
| C、装饰材料中的甲醛和芳香烃会造成居室污染 |
| D、磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
向容积为2L的密闭容器中充入2mol A气体和1mol B气体,一定条件下发生如下反应2A(g)+B(g)?3C(g),经2s后达到平衡,测得C的浓度为0.6mol/L.下列说法中不正确的是( )
| A、用物质A表示该反应的平均反应速率为0.2mol?L-1?s-1 |
| B、平衡时物质A和B的转化率相等 |
| C、平衡时物质B的浓度为0.2mol/L |
| D、若将容积体积压缩为1L,B的平衡浓度变为原来的2倍 |
 实验室用NaCl固体配制0.40mol/L的NaCl溶液250mL.
实验室用NaCl固体配制0.40mol/L的NaCl溶液250mL.