题目内容
向容积为2L的密闭容器中充入2mol A气体和1mol B气体,一定条件下发生如下反应2A(g)+B(g)?3C(g),经2s后达到平衡,测得C的浓度为0.6mol/L.下列说法中不正确的是( )
| A、用物质A表示该反应的平均反应速率为0.2mol?L-1?s-1 |
| B、平衡时物质A和B的转化率相等 |
| C、平衡时物质B的浓度为0.2mol/L |
| D、若将容积体积压缩为1L,B的平衡浓度变为原来的2倍 |
考点:化学平衡的计算
专题:化学平衡专题
分析:向容积为2L的密闭容器中充入2mol A气体和1mol B气体,则起始时A的浓度为1mol/L,B的浓度为0.5mol/L,
2A(g)+B(g)?3C(g)
起始(mol/):1 0.5 0
转化(mol/):0.4 0.2 0.6
平衡(mol/):0.6 0.3 0.6
结合v=
计算.
2A(g)+B(g)?3C(g)
起始(mol/):1 0.5 0
转化(mol/):0.4 0.2 0.6
平衡(mol/):0.6 0.3 0.6
结合v=
| △c |
| △t |
解答:
解:向容积为2L的密闭容器中充入2mol A气体和1mol B气体,则起始时A的浓度为1mol/L,B的浓度为0.5mol/L,
2A(g)+B(g)?3C(g)
起始(mol/):1 0.5 0
转化(mol/):0.4 0.2 0.6
平衡(mol/):0.6 0.3 0.6
A、v(A)=
=0.2mol/(L?s),故A正确;
B、平衡时物质A的转化率为
×100%=40%,B的转化率为
×100%=40%,转化率相等,故B正确;
C、平衡时物质B的浓度为0.3mol/L,故C错误;
D、若将容积体积压缩为1L,反应前后气体体积不变,压强增大平衡不变,B的平衡浓度变为原来的2倍,故D正确;
故选C.
2A(g)+B(g)?3C(g)
起始(mol/):1 0.5 0
转化(mol/):0.4 0.2 0.6
平衡(mol/):0.6 0.3 0.6
A、v(A)=
| 0.4mol/L |
| 2s |
B、平衡时物质A的转化率为
| 0.4mol/L |
| 1mol/L |
| 0.2mol/L |
| 0.5mol/L |
C、平衡时物质B的浓度为0.3mol/L,故C错误;
D、若将容积体积压缩为1L,反应前后气体体积不变,压强增大平衡不变,B的平衡浓度变为原来的2倍,故D正确;
故选C.
点评:本题考查了化学平衡的计算应用,主要是反应速率、转化率的计算分析,掌握基础是关键,题目较简单.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案
相关题目
已知450℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数K=100,由此推测在450℃时,反应HI(g)?
H2(g)+
I2(g)的平衡常数为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、0.01 | B、50 |
| C、100 | D、0.1 |
草药莪术根茎中含有一种色素,它的结构如图,用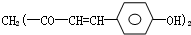 它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的NaOH和H2的最大量分别为( )
它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的NaOH和H2的最大量分别为( )
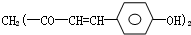 它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的NaOH和H2的最大量分别为( )
它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的NaOH和H2的最大量分别为( )| A、3mol,3mol |
| B、1mol,5mol |
| C、6mol,8mol |
| D、2mol,10mol |
某温度下,反应2CH3OH(g)?CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
下列说法不正确的是( )
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
| A、CH3OH的起始浓度为1.64 mol/L |
| B、此时逆反应速率小于正反应速率 |
| C、平衡时,CH3OH的浓度为0.04 mol/L |
| D、平衡时,CH3OH的转化率小于90% |
N2和H2的物质的量之比为2:3的混合气体充入一容积固定的密闭容器中,在一定的条件下发生反应,当达到平衡时,容器内的压强为反应开始时的
,则N2的转化率为( )
| 4 |
| 5 |
| A、50% | B、37.5% |
| C、25% | D、12.5% |
100mL 2mol/L的硫酸和过量的锌反应,为加快反应速率,但又不影响生成氢气的总量,可采取的措施是( )
| A、升高温度 |
| B、改用含有少量杂质铜的锌 |
| C、改用98%的浓硫酸 |
| D、加水 |
化学与生活、社会密切相关.下列说法正确的是( )
| A、石油的分馏、煤的气化、海水提溴过程都包含化学变化 |
| B、地沟油经处理后可作为汽车燃油,故地沟油成分是液态烃 |
| C、淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| D、乙烯和苯都能使溴水褪色,且褪色的原因相同 |