题目内容
下列关于有机物的说法错误的是( )
A、由CH2=CHCOOCH3合成的聚合物为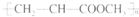 |
| B、溴乙烷与NaOH乙醇溶液共热生成乙烯 |
| C、装饰材料中的甲醛和芳香烃会造成居室污染 |
| D、磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
考点:有机化学反应的综合应用
专题:有机反应
分析:A、根据加聚反应原理判断;
B、根据溴乙烷的化学性质进行判断.
C、甲醛和芳香烃(苯)为常见的有机溶剂,有毒.
D、蛋白质要在催化剂作用下才能水解为氨基酸.
B、根据溴乙烷的化学性质进行判断.
C、甲醛和芳香烃(苯)为常见的有机溶剂,有毒.
D、蛋白质要在催化剂作用下才能水解为氨基酸.
解答:
解:A、烯烃发生加聚时,只是双键中一个键断开,不饱和碳连在一起,故链节中只出现不饱和碳,没有其他官能团,正确结构简式为: 故A错误;
故A错误;
B、溴乙烷与氢氧化钠的醇溶液加热发生消去反应生成乙烯,故B正确;
C、甲醛和芳香烃(苯)为常见的有机溶剂,有毒,则装饰材料中的甲醛和芳香烃会造成居室污染,故C正确;
D、豆浆煮沸是蛋白质发生了变性,故D错误.
故选AD.
 故A错误;
故A错误;B、溴乙烷与氢氧化钠的醇溶液加热发生消去反应生成乙烯,故B正确;
C、甲醛和芳香烃(苯)为常见的有机溶剂,有毒,则装饰材料中的甲醛和芳香烃会造成居室污染,故C正确;
D、豆浆煮沸是蛋白质发生了变性,故D错误.
故选AD.
点评:本题考查较综合,侧重常见有机物性质及发生的反应的考查,把握加聚反应特点,注意大多数有机物有毒,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
已知450℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数K=100,由此推测在450℃时,反应HI(g)?
H2(g)+
I2(g)的平衡常数为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、0.01 | B、50 |
| C、100 | D、0.1 |
草药莪术根茎中含有一种色素,它的结构如图,用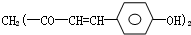 它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的NaOH和H2的最大量分别为( )
它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的NaOH和H2的最大量分别为( )
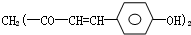 它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的NaOH和H2的最大量分别为( )
它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的NaOH和H2的最大量分别为( )| A、3mol,3mol |
| B、1mol,5mol |
| C、6mol,8mol |
| D、2mol,10mol |
100mL 2mol/L的硫酸和过量的锌反应,为加快反应速率,但又不影响生成氢气的总量,可采取的措施是( )
| A、升高温度 |
| B、改用含有少量杂质铜的锌 |
| C、改用98%的浓硫酸 |
| D、加水 |
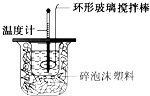 某实验小组用0.50mol?L-1 NaOH溶液和0.55mol?L-1盐酸溶液进行中和热的测定.Ⅰ.配制0.50mol?L-1 NaOH溶液
某实验小组用0.50mol?L-1 NaOH溶液和0.55mol?L-1盐酸溶液进行中和热的测定.Ⅰ.配制0.50mol?L-1 NaOH溶液 (1)已知:N2(g)+O2(g)═2NO(g)△H1
(1)已知:N2(g)+O2(g)═2NO(g)△H1