题目内容
在一个容积为500mL的密闭容器中,充入5molH2和2molCO.在一定条件下发生如下反应:2H2(g)+CO(g)?CH3OH(g),经过5min后达到平衡状态.若此时测得甲醇蒸汽的浓度为2mol/L,求:
(1)以H2的浓度减少量来表示的反应速率.
(2)达到平衡时CO的转化率.
(3)平衡时H2的浓度. .
(1)以H2的浓度减少量来表示的反应速率.
(2)达到平衡时CO的转化率.
(3)平衡时H2的浓度.
考点:化学平衡的计算
专题:化学平衡专题
分析:依据化学平衡三段式列式计算,经过5min后达到平衡状态.若此时测得CH3OH蒸气的浓度为2mol/L.物质的量为0.5L×2mol/L=1mol;
2H2(g)+CO(g)?CH3OH(g)
起始量(mol) 5 2 0
变化量(mol) 2 1 1
平衡量(mol) 3 1 1
据此计算反应速率V=
,转化率=
×100%,浓度c=
.
2H2(g)+CO(g)?CH3OH(g)
起始量(mol) 5 2 0
变化量(mol) 2 1 1
平衡量(mol) 3 1 1
据此计算反应速率V=
| △c |
| △t |
| 消耗量 |
| 起始量 |
| n |
| V |
解答:
解:经过5min后达到平衡状态.若此时测得CH3OH蒸气的浓度为2mol/L.物质的量为0.5L×2mol/L=1mol;
2H2(g)+CO(g)?CH3OH(g)
起始量(mol) 5 2 0
变化量(mol) 2 1 1
平衡量(mol) 3 1 1
(1)H2的浓度变化表示的该反应的速率=
=0.8mol/(L?min),
故答案为:0.8mol/(L?min);
(2)一氧化碳转化率=
×100%=50%;
故答案为:50%;
(3)平衡时H2的浓度=
=6mol/L;
故答案为:6mol/L.
2H2(g)+CO(g)?CH3OH(g)
起始量(mol) 5 2 0
变化量(mol) 2 1 1
平衡量(mol) 3 1 1
(1)H2的浓度变化表示的该反应的速率=
| ||
| 5min |
故答案为:0.8mol/(L?min);
(2)一氧化碳转化率=
| 1mol |
| 2mol |
故答案为:50%;
(3)平衡时H2的浓度=
| 3mol |
| 0.5L |
故答案为:6mol/L.
点评:本题考查了化学平衡计算应用,主要是转化率、反应速率、平衡浓度概念的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
在一定温度下,某无水盐R在水中溶解度为23g,向R的饱和溶液中加入B g该盐,保持温度不变,析出R结晶水合物W g,从原饱和溶液中析出溶质R的质量为( )
A、(W-B)
| ||
B、(W-B)
| ||
C、(W-B)
| ||
D、(W-
|
某化学反应经过2min,生成物Y的浓度从0增加到0.24mol/L,而反应物X的浓度从0.3mol/L变成0.22mol/L.该反应可能是( )
| A、X+2Z→3Y |
| B、X+Z→2Y |
| C、3X→Y+Z |
| D、X→Y+3Z |
已知450℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数K=100,由此推测在450℃时,反应HI(g)?
H2(g)+
I2(g)的平衡常数为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、0.01 | B、50 |
| C、100 | D、0.1 |
N2和H2的物质的量之比为2:3的混合气体充入一容积固定的密闭容器中,在一定的条件下发生反应,当达到平衡时,容器内的压强为反应开始时的
,则N2的转化率为( )
| 4 |
| 5 |
| A、50% | B、37.5% |
| C、25% | D、12.5% |
 Ⅰ:工业上用CO2和H2在一定条件发生如下反应合成甲醇并放出大量的热:CO2(g)+3H2(g)?CH3OH(g)+、H2O(g)△H1 回答下列问题.
Ⅰ:工业上用CO2和H2在一定条件发生如下反应合成甲醇并放出大量的热:CO2(g)+3H2(g)?CH3OH(g)+、H2O(g)△H1 回答下列问题.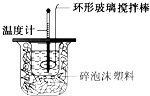 某实验小组用0.50mol?L-1 NaOH溶液和0.55mol?L-1盐酸溶液进行中和热的测定.Ⅰ.配制0.50mol?L-1 NaOH溶液
某实验小组用0.50mol?L-1 NaOH溶液和0.55mol?L-1盐酸溶液进行中和热的测定.Ⅰ.配制0.50mol?L-1 NaOH溶液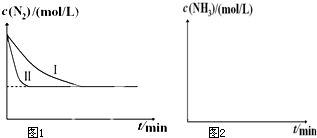 (1)已知:N2(g)+O2(g)═2NO(g)△H1
(1)已知:N2(g)+O2(g)═2NO(g)△H1