题目内容
一定温度下,在固定容积、体积为2L的密闭容器中充入1molN2和3molH2发生反应,当反应进行到10s末时达到平衡,此时容器中c(NH3)=0.15mol?L-1.下列有关判断不正确的是( )
| A、反应达平衡时N2的转化率为7.5% |
| B、反应进行到10s末时,H2的平均反应速率是0.0225mol?(L?s)-1 |
| C、该反应达到平衡时的标志是容器中气体压强不再改变 |
| D、该反应达到平衡时的标志是容器中气体密度不再改变 |
考点:化学平衡的计算
专题:化学平衡专题
分析:A.根据氨气的浓度变化量计算氮气的浓度变化量,氮气平衡转化率等于其浓度变化量除以其起始浓度;
B.根据v=
先计算氨气的速率,再根据速率之比等于系数之比计算v(H2);
C.因为化学反应前后是气体体积变化的反应,所以容器内反应混合气体的压强随反应的方向始终在变化;
D.容器内反应混合气体的密度始终不变.
B.根据v=
| △c |
| △t |
C.因为化学反应前后是气体体积变化的反应,所以容器内反应混合气体的压强随反应的方向始终在变化;
D.容器内反应混合气体的密度始终不变.
解答:
解:发生反应:N2(g)+3H2(g) 2NH3(g),
2NH3(g),
A.平衡时容器中c(NH3)=0.15mol/L,则氮气的浓度变化量=0.15mol/L×
=0.075mol/L,故氮气的转化率=
×100%=15%,故A错误;
B.10s末时达到平衡时容器中c(NH3)=0.15mol/L,故v(NH3)=
=0.015mol/(L.s),v(H2)=
v(NH3)=0.0225mol/(L.s),故B正确,
C.因为化学反应前后是气体体积变化的反应,所以容器内反应混合气体的压强随反应的方向始终在变化,故容器中气体压强不再改变能说明平衡到达平衡,故C正确;
D.容器内总质量和体积始终不变,所以反应混合气体的密度也始终不变,故容器中气体密度不改变不能说明平衡到达平衡,故D错误;
故选AD.
 2NH3(g),
2NH3(g),A.平衡时容器中c(NH3)=0.15mol/L,则氮气的浓度变化量=0.15mol/L×
| 1 |
| 2 |
| 0.075mol/L | ||
|
B.10s末时达到平衡时容器中c(NH3)=0.15mol/L,故v(NH3)=
| 0.15mol/L |
| 10s |
| 3 |
| 2 |
C.因为化学反应前后是气体体积变化的反应,所以容器内反应混合气体的压强随反应的方向始终在变化,故容器中气体压强不再改变能说明平衡到达平衡,故C正确;
D.容器内总质量和体积始终不变,所以反应混合气体的密度也始终不变,故容器中气体密度不改变不能说明平衡到达平衡,故D错误;
故选AD.
点评:本题考查化学平衡有关计算及影响因素,难度中等,C选项压强判断一定注意化学反应前后气体体积是否变化.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列物质是碱性氧化物的是( )
| A、CO2 |
| B、H2O |
| C、CaO |
| D、H2SO4 |
已知450℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数K=100,由此推测在450℃时,反应HI(g)?
H2(g)+
I2(g)的平衡常数为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、0.01 | B、50 |
| C、100 | D、0.1 |
某温度下,反应2CH3OH(g)?CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
下列说法不正确的是( )
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
| A、CH3OH的起始浓度为1.64 mol/L |
| B、此时逆反应速率小于正反应速率 |
| C、平衡时,CH3OH的浓度为0.04 mol/L |
| D、平衡时,CH3OH的转化率小于90% |
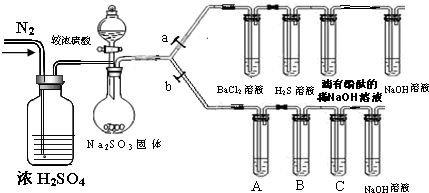
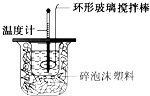 某实验小组用0.50mol?L-1 NaOH溶液和0.55mol?L-1盐酸溶液进行中和热的测定.Ⅰ.配制0.50mol?L-1 NaOH溶液
某实验小组用0.50mol?L-1 NaOH溶液和0.55mol?L-1盐酸溶液进行中和热的测定.Ⅰ.配制0.50mol?L-1 NaOH溶液