题目内容
3.氢化钠(NaH)是一种白色的离子化合物,其中钠元素是+1价;氢化钠与水反应放出H2.下列叙述中,正确的是( )| A. | NaH在水中显碱性 | |
| B. | NaH中氢元素的离子的电子层排布与氖原子的电子层排布相同 | |
| C. | 微粒半径H-<Li+ | |
| D. | NaH与H2O反应时,水作还原剂 |
分析 A.氢化钠和水反应生成氢气和氢氧化钠;
B.NaH中H元素是-1价,其核外电子数为2;
C.电子排布相同时,原子序数越大,离子半径越小;
D.得电子的物质为氧化剂.
解答 解:A.氢化钠和水发生:NaH+H2O=H2+NaOH,有NaOH生成,其水溶液显碱性,故A正确;
B.NaH中H元素是-1价,其核外电子数为2,所以其电子层排布与氦原子的相同,故B错误;
C.H-离子半径大于Li+离子半径,故C错误;
D.NaH与H2O反应NaH+H2O=NaOH+H2↑,反应中水中的氢元素化合价降低,因此水做氧化剂,故D错误.
故选A.
点评 本题以钠的化合物为载体综合考查了粒子半径比较及元素化合物的知识,为高考常见题型,侧重考查学生的分析能力,题目难度不大,注意利用盐类水解理解NaH与水的反应.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
13.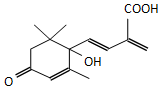 鲜花保鲜剂S-诱抗素制剂,可保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法不正确的是( )
鲜花保鲜剂S-诱抗素制剂,可保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法不正确的是( )
 鲜花保鲜剂S-诱抗素制剂,可保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法不正确的是( )
鲜花保鲜剂S-诱抗素制剂,可保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法不正确的是( )| A. | 其分子式为C14H20O4 | |
| B. | 该物质中含有3种含氧官能团 | |
| C. | 既能发生加成反应,又能发生取代反应 | |
| D. | 既能使紫色石蕊试剂显红色,又能使酸性KMnO4溶液褪色 |
14.某有机物的结构简式为 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该物质的分子式为C11H10O3 | |
| B. | 该有机物含有4种官能团 | |
| C. | 1 mol该有机物最多可以消耗2 mol NaOH | |
| D. | 该有机物不能发生消去反应 |
11.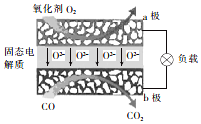 为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )
为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )
 为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )
为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )| A. | 电子从b极经导线流向a极 | |
| B. | 正极的电极反应式为O2+4e-+2H2O═4OH- | |
| C. | 还可以选用NaOH固体作固态电解质 | |
| D. | 若反应中转移1 mol电子,则生成22.4L(标准状况)CO2 |
18.下列关于元素周期表的描述正确的是( )
| A. | 有7个周期,18个族 | |
| B. | 第IA族元素也称为碱金属元素 | |
| C. | 元素种类最多的族为第IIIB族 | |
| D. | 第七周期若排满,最多可排50种元素 |
8.“漆器”是中国古代在化学工艺及工艺美术方面的重要发明,所用生漆是从我国特产漆树割取的天然液汁.生漆主要成分是漆酚  ,-C15H27为链烃基,则漆酚不应具有的化学性质是( )
,-C15H27为链烃基,则漆酚不应具有的化学性质是( )
 ,-C15H27为链烃基,则漆酚不应具有的化学性质是( )
,-C15H27为链烃基,则漆酚不应具有的化学性质是( )| A. | 可以跟FeCl3溶液发生显色反应 | B. | 可以使酸性KMnO4溶液褪色 | ||
| C. | 可以跟Na2CO3溶液反应放出CO2 | D. | 可以发生取代反应和加成反应 |
12.含有元素硒(Se)的保健品已开始进入市场.已知它与氧同族,与钾同周期.则下列关于硒的叙述中,正确的是( )
| A. | 金属性比钾强 | B. | 最高价氧化物的化学式是SeO3 | ||
| C. | 高价含氧酸的酸性:H2SeO4>H2SO4 | D. | 氢化物稳定性:H2Se>H2O |
 .
.