题目内容
下列表述正确的是( )
| A、H2、D2、T2互为同位素 |
| B、金属氧化物均为碱性氧化物 |
| C、质量数为131,中子数为78的碘原子常用于核反应堆的燃料棒.其核外电子数为53 |
D、S2-的结构示意图: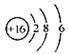 |
考点:同位素及其应用,酸、碱、盐、氧化物的概念及其相互联系,质量数与质子数、中子数之间的相互关系
专题:
分析:A.有相同质子数,不同中子数的原子互为同位素;
B.金属氧化物不一定为碱性氧化物;
C.根据质子数=质量数-中子数,电子数=质子数进行计算;
D.S2-的核电荷数为16,核外电子数为18,据此书写结构示意图.
B.金属氧化物不一定为碱性氧化物;
C.根据质子数=质量数-中子数,电子数=质子数进行计算;
D.S2-的核电荷数为16,核外电子数为18,据此书写结构示意图.
解答:
解:A.H2、D2和T2为氢分子,不是原子,故A错误;
B.金属氧化物不一定为碱性氧化物,如氧化铝为两性氧化物,故B错误;
C.质子数=质量数-中子数=131-78=53,电子数=质子数=53,故C正确;
D.S2-的核电荷数为16,核外电子数为18,故结构示意图为 ,故D错误;
,故D错误;
故选C.
B.金属氧化物不一定为碱性氧化物,如氧化铝为两性氧化物,故B错误;
C.质子数=质量数-中子数=131-78=53,电子数=质子数=53,故C正确;
D.S2-的核电荷数为16,核外电子数为18,故结构示意图为
 ,故D错误;
,故D错误;故选C.
点评:本题考查同位素、离子结构示意图等化学用语,碱性氧化物的判断,质量数、质子数、中子数、电子数之间的关系难度不大.把握化学用语的规范应用是解答的关键.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生.下列属于新能源( )
①天然气 ②氢能 ③生物质能 ④太阳能 ⑤石油 ⑥燃料电池 ⑦风能 ⑧煤.
①天然气 ②氢能 ③生物质能 ④太阳能 ⑤石油 ⑥燃料电池 ⑦风能 ⑧煤.
| A、①②③④⑥ |
| B、④⑤⑥⑦⑧ |
| C、③④⑤⑥⑦ |
| D、②③④⑥⑦ |
下列各物质所含原子数目,按由大到小顺序排列的是( )
①0.6mol NH3
②标准状况下22.4L He
③4℃9mL水(ρ=1g/mL)
④19.6g H2SO4.
①0.6mol NH3
②标准状况下22.4L He
③4℃9mL水(ρ=1g/mL)
④19.6g H2SO4.
| A、②①③④ | B、①③④② |
| C、①④③② | D、②③④① |
下列溶液中氯离子的物质的量浓度与50mL 1mol/L的AlCl3溶液中氯离子的物质的量浓度相等的是( )
| A、75 mL 2 mol/L的CaCl2 |
| B、150 mL 3 mol/L的KCl |
| C、150 mL 1 mol/L的NaCl |
| D、75mL 2 mol/L的NH4Cl |
下列反应的离子方程正确的是( )
| A、硫酸溶液中加入氢氧化钡溶液 Ba2++SO42-=BaSO4↓ |
| B、钠与水反应 Na+2H2O=Na++2OH-+H2↑ |
| C、碳酸钠溶液中加入足量盐酸 CO32-+2H+=CO2↑+H2O |
| D、铝片与硝酸汞溶液反应 Al+Hg2+=Al 3++Hg |
已知H2(g)+Cl2(g)=2HCl(g)△H=-92.3kJ?mol-1,则反应2HCl(g)=H2(g)+Cl2(g)的△H为( )
| A、+184.6kJ?mol-1 |
| B、-92.3kJ?mol-1 |
| C、-369.2kJ?mol-1 |
| D、+92.3kJ?mol- |
某元素X最高价含氧酸的分子量为98,且X的氢化物的分子式是H2X,则下列说法正确的是( )
| A、X的最高化合价为+4 |
| B、X是第三周期VA族元素 |
| C、X是第三周ⅥA族元素 |
| D、X的最高价含氧酸的分子式可表示为H2XO3 |