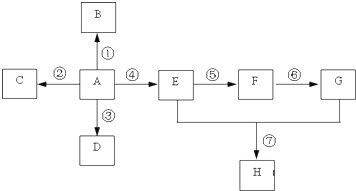
题目内容
已知H2(g)+Cl2(g)=2HCl(g)△H=-92.3kJ?mol-1,则反应2HCl(g)=H2(g)+Cl2(g)的△H为( )
| A、+184.6kJ?mol-1 |
| B、-92.3kJ?mol-1 |
| C、-369.2kJ?mol-1 |
| D、+92.3kJ?mol- |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:热化学方程式中的系数表示各物质的物质的量,其反应热和方程式的系数成正比,△H符号和方程式的书写有关,正反应和逆反应的△H符号刚好相反,数值相同.
解答:
解:反应2HCl(g)=H2(g)+Cl2(g)可以看成是反应H2(g)+Cl2(g)=2HCl(g)方程式颠倒的结果,所以反应2HCl(g)=H2(g)+Cl2(g)的△H=+184.6kJ/mol.
故选A.
故选A.
点评:本题考查热化学方程式中焓变的含义,是对教材知识的考查,较简单.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案
相关题目
现有A、B、C、D四种短周期元素,其中两种是金属元素.已知A、B同主族,B、C、D同周期,A、B的原子序数之和等于C、D的原子序数之和,C的单质能分别跟B和D的最高价氧化物的水化物反应.下列说法正确的是( )
| A、A的氢化物比B的氢化物难分解是因为A分子间能形成氢键 |
| B、含C元素的盐溶液一定呈酸性 |
| C、将a g C6H12O6在足量氧气中燃烧产物通入足量A和D按原子个数比1:1组成的化合物中,该化合物增重a g |
| D、D和A两元素形成的化合物,阴阳离子个数比分别为为1:1 和1:2 |
用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、1 mol Na2O2晶体中共含有4NA个离子 |
| B、0.1 mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| C、常温常压下16 g O2和O3混合气体含有NA个氧原子 |
| D、1 mol/L的CaCl2溶液中含Cl-的数目为2NA |
下列说法正确的是( )
| A、摩尔是物质的数量单位 |
| B、氢气的摩尔质量是2g |
| C、1molNH3的质量是17g |
| D、1mol气体所占的体积约为22.4L |
下列表述正确的是( )
| A、H2、D2、T2互为同位素 |
| B、金属氧化物均为碱性氧化物 |
| C、质量数为131,中子数为78的碘原子常用于核反应堆的燃料棒.其核外电子数为53 |
D、S2-的结构示意图: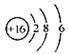 |
已知R元素的原子结构示意图为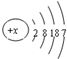 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A、R元素是第4周期Ⅶ族元素 |
| B、R元素的原子在反应中易失去电子 |
| C、R元素的最高价氧化物对应水化物为HRO4 |
| D、R元素的气态氢化物比同主族的上一周期元素的气态氢化物稳定性强 |