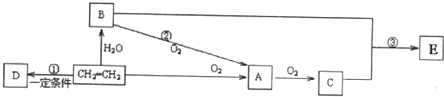
题目内容
已知A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增.A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,F在本周期元素中原子半径最小.则:
(1)E、F的名称分别是 、 ;C的基态原子的电子排布式为 .
(2)在A至F中任选元素,写出一种含极性键的非极性分子的分子式 ,写出一种含非极性键的离子化合物的电子式 .
(3)由B和D组成,且B和D的质量比为3:8的化合物的结构式是 ,该化合物分子中B原子的杂化方式为 .
(4)E和F形成的化合物为 晶体.用石墨作电极电解其饱和溶液的阳极电极反应式为 .
(1)E、F的名称分别是
(2)在A至F中任选元素,写出一种含极性键的非极性分子的分子式
(3)由B和D组成,且B和D的质量比为3:8的化合物的结构式是
(4)E和F形成的化合物为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A原子的电子层数与它的核外电子总数相同,应为H元素,B原子的最外层电子数是次外层的2倍,应为C元素,C的氢化物可使湿润的红色石蕊试纸变蓝,应为N元素,形成的氢化物为氨气,为碱性气体,B和D可以形成两种气态化合物,应分别为CO和CO2,则D为O元素,E原子核外电子总数比B的2倍少1,则E的原子序数为11,应为Na元素,A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增,且F在本周期元素中原子半径最小,应为Cl元素,以此解答该题.
解答:
解:A原子的电子层数与它的核外电子总数相同,应为H元素,B原子的最外层电子数是次外层的2倍,应为C元素,C的氢化物可使湿润的红色石蕊试纸变蓝,应为N元素,形成的氢化物为氨气,为碱性气体,B和D可以形成两种气态化合物,应分别为CO和CO2,则D为O元素,E原子核外电子总数比B的2倍少1,则E的原子序数为11,应为Na元素,A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增,且F在本周期元素中原子半径最小,应为Cl元素,
综上所述:A、B、C、D、E、F的名称分别是氢、碳、氮、氧、钠、氯,
(1)E为钠,F为氯,C为氮,N的基态原子的电子排布式为:1s22s22p3,故答案为:钠;氯;1s22s22p3;
(2)在H、C、N、O、Na、Cl中任选元素,含极性键的非极性分子有CO2、CH4、CCl4等,含非极性键的离子化合物为Na2O2,电子式为 ,
,
故答案为:CO2、CH4、CCl4(任写一种); ;
;
(3)由C和O组成,且C和O的质量比为3:8的化合物为CO2,结构式为:O=C=O,二氧化碳为直线型结构,C原子采取sp杂化类型,故答案为:O=C=O;sp;
(4)E和F形成的化合物是氯化钠,为离子晶体,电解饱和食盐水,阳极为氯离子放电生成氯气,电极反应方程式为:2Cl-2e-=Cl2↑,故答案为:离子;2Cl-2e-=Cl2↑.
综上所述:A、B、C、D、E、F的名称分别是氢、碳、氮、氧、钠、氯,
(1)E为钠,F为氯,C为氮,N的基态原子的电子排布式为:1s22s22p3,故答案为:钠;氯;1s22s22p3;
(2)在H、C、N、O、Na、Cl中任选元素,含极性键的非极性分子有CO2、CH4、CCl4等,含非极性键的离子化合物为Na2O2,电子式为
 ,
,故答案为:CO2、CH4、CCl4(任写一种);
 ;
;(3)由C和O组成,且C和O的质量比为3:8的化合物为CO2,结构式为:O=C=O,二氧化碳为直线型结构,C原子采取sp杂化类型,故答案为:O=C=O;sp;
(4)E和F形成的化合物是氯化钠,为离子晶体,电解饱和食盐水,阳极为氯离子放电生成氯气,电极反应方程式为:2Cl-2e-=Cl2↑,故答案为:离子;2Cl-2e-=Cl2↑.
点评:本题考查较为综合,设计元素的推断、电子式、结构式、杂化类型、晶体类型等问题,题目难度中等,注意常见物质的电子式的书写.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列表述正确的是( )
| A、H2、D2、T2互为同位素 |
| B、金属氧化物均为碱性氧化物 |
| C、质量数为131,中子数为78的碘原子常用于核反应堆的燃料棒.其核外电子数为53 |
D、S2-的结构示意图: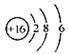 |
现有一Na2SO3、Na2SO4混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是( )
| A、将样品配制成溶液V1 L,取其中25.00mL用标准KMnO4溶液滴定,消耗标准KMnO4溶液V2 mL |
| B、向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg |
| C、将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c g |
| D、将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管Ⅰ、盛有碱石灰的干燥管Ⅱ,测定干燥管Ⅰ增重d g |
已知R元素的原子结构示意图为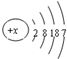 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A、R元素是第4周期Ⅶ族元素 |
| B、R元素的原子在反应中易失去电子 |
| C、R元素的最高价氧化物对应水化物为HRO4 |
| D、R元素的气态氢化物比同主族的上一周期元素的气态氢化物稳定性强 |
W、X、Y、Z、R属于短周期元素.已知它们都不是稀有气体元素,W的原子半径是所属周期中最大,X元素的原子最外层电子数为m,次外层电子数为n,Y元素的原子L层电子数为m+n,M层电子数m-n,Z元素与Y元素同主族,R元素原子与X元素原子的核外电子数之比为2:1.下列叙述中,错误的是( )
| A、分别由Y、Z组成的单质一定都为原子晶体 |
| B、W与X形成的两种化合物中阴、阳离子的个数比均为1:2 |
| C、Y、Z、R最高价氧化物对应水化物的酸性强弱顺序:R>Z>Y |
| D、X的氢化物比R的氢化物稳定,X的氢化物熔沸点比R的氢化物高 |
下列基本实验操作中,不合理的是( )
| A、配制一定物质的量浓度溶液,向容量瓶加水至离刻度线1~2cm时,改用胶头滴管定容 |
| B、可用湿润的pH试纸检验氨气 |
| C、用洁净的铂丝蘸取待测溶液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色,该溶液中一定含有钾离子,不含有钠离子 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |