题目内容
某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.实验步骤如下,回答下列问题:
(1)用分析天平准确称取该样品5.000g,全部溶于水配制成1000.0mL的溶液.用 (填一仪器名称)量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,待测.
(2)用浓度为0.1000mol/L的盐酸标准溶液进行滴定.滴定管在使用前应先检漏、洗涤、 、正式装液,排除气泡并调节液面.
(3)滴定过程中,锥形瓶中溶液的pH变化如下
该中和滴定中可选用的指示剂是 ,滴定终点的现象是 .(如有几种,可任填一种)
(4)若滴定前滴定管尖嘴部分有气泡,滴定终了没有气泡,则会造成计算值 (填“偏大”、“偏小”或“无法确定”).样品中,NaOH的质量百分含量为 .
(1)用分析天平准确称取该样品5.000g,全部溶于水配制成1000.0mL的溶液.用
(2)用浓度为0.1000mol/L的盐酸标准溶液进行滴定.滴定管在使用前应先检漏、洗涤、
(3)滴定过程中,锥形瓶中溶液的pH变化如下
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
(4)若滴定前滴定管尖嘴部分有气泡,滴定终了没有气泡,则会造成计算值
考点:中和滴定
专题:实验题
分析:(1)氢氧化钠溶液属于强碱,应该使用碱式滴定管;
(2)根据滴定管的使用方法完成;
(3)依据图象和图表数据分析出PH突变,根据pH突变选择指示剂;根据滴定结束前溶液显示碱性,滴定结束时滴入盐酸,溶液酸性酸性进行判断滴定终点;
(4)滴定前滴定管尖嘴部分有气泡,滴定终了没有气泡,导致滴定时消耗的标准液体积偏大;根据消耗的标准液的体积计算出氢氧化钠溶液的浓度,再计算出样品中含有的氢氧化钠的质量及质量分数.
(2)根据滴定管的使用方法完成;
(3)依据图象和图表数据分析出PH突变,根据pH突变选择指示剂;根据滴定结束前溶液显示碱性,滴定结束时滴入盐酸,溶液酸性酸性进行判断滴定终点;
(4)滴定前滴定管尖嘴部分有气泡,滴定终了没有气泡,导致滴定时消耗的标准液体积偏大;根据消耗的标准液的体积计算出氢氧化钠溶液的浓度,再计算出样品中含有的氢氧化钠的质量及质量分数.
解答:
解:(1)滴定时,氢氧化钠溶液使用碱式滴定管盛取,故答案为:碱式滴定管;
(2)滴定管在使用前应先检漏、洗涤、用待装液润洗、正式装液,排除气泡并调节液面,故答案为:用待装液润洗;
(3)依据图象和图表数据分析可知pH突变是4.0~9.9,盐酸和氢氧化钠恰好反应生成的氯化钠溶液呈中性,甲基橙变色范围为3.1-4.4,酚酞pH变色范围为8.2~10.0,甲基橙和酚酞都可以用作指示剂;由于石蕊变色时不容易判断,一般不选作指示剂;
滴定结束前,溶液为碱性,溶液颜色为红色,滴定结束时有粉红色变成无色,所以滴定终点的现象是溶液由黄色变成橙色其半分钟不褪色(或溶液由粉红色变为无色且半分钟不褪色),
故答案为:甲基橙或酚酞;溶液由黄色变成橙色其半分钟不褪色(或溶液由粉红色变为无色且半分钟不褪色);
(4)滴定前滴定管尖嘴部分有气泡,滴定终了没有气泡,导致消耗的标准液体积偏大,测定结果偏大,
氢氧化钠溶液的浓度为:
=0.1200mol/L,
样品中含有的氢氧化钠的物质的量为:0.1200mol/L×1L=0.12mol,氢氧化钠的质量为:40g/mol×0.12mol=4.800g,
故样品中,NaOH的质量百分含量为:
×100%=96%,
故答案为:偏大;96%.
(2)滴定管在使用前应先检漏、洗涤、用待装液润洗、正式装液,排除气泡并调节液面,故答案为:用待装液润洗;
(3)依据图象和图表数据分析可知pH突变是4.0~9.9,盐酸和氢氧化钠恰好反应生成的氯化钠溶液呈中性,甲基橙变色范围为3.1-4.4,酚酞pH变色范围为8.2~10.0,甲基橙和酚酞都可以用作指示剂;由于石蕊变色时不容易判断,一般不选作指示剂;
滴定结束前,溶液为碱性,溶液颜色为红色,滴定结束时有粉红色变成无色,所以滴定终点的现象是溶液由黄色变成橙色其半分钟不褪色(或溶液由粉红色变为无色且半分钟不褪色),
故答案为:甲基橙或酚酞;溶液由黄色变成橙色其半分钟不褪色(或溶液由粉红色变为无色且半分钟不褪色);
(4)滴定前滴定管尖嘴部分有气泡,滴定终了没有气泡,导致消耗的标准液体积偏大,测定结果偏大,
氢氧化钠溶液的浓度为:
| 0.1000mol/L×0.024L |
| 0.02L |
样品中含有的氢氧化钠的物质的量为:0.1200mol/L×1L=0.12mol,氢氧化钠的质量为:40g/mol×0.12mol=4.800g,
故样品中,NaOH的质量百分含量为:
| 4.800g |
| 5.000g |
故答案为:偏大;96%.
点评:本题考查了酸碱中和滴定实验的操作步骤、反应终点的图象绘制、终点判断,题目难度中等,指示剂的选择是解题关键,

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
将一定体积的密度为1.32g/cm3的硫酸溶液逐滴滴入到BaCl2溶液中,直到沉淀恰好完全为止.已知反应后所得溶液的质量等于原BaCl2溶液的质量,则原H2SO4溶液的浓度为( )
| A、21.9% |
| B、11.0% |
| C、13.5mol/L |
| D、5.67mol/L |
下列表述正确的是( )
| A、H2、D2、T2互为同位素 |
| B、金属氧化物均为碱性氧化物 |
| C、质量数为131,中子数为78的碘原子常用于核反应堆的燃料棒.其核外电子数为53 |
D、S2-的结构示意图: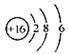 |
现有一Na2SO3、Na2SO4混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是( )
| A、将样品配制成溶液V1 L,取其中25.00mL用标准KMnO4溶液滴定,消耗标准KMnO4溶液V2 mL |
| B、向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg |
| C、将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c g |
| D、将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管Ⅰ、盛有碱石灰的干燥管Ⅱ,测定干燥管Ⅰ增重d g |