题目内容
下列反应的离子方程正确的是( )
| A、硫酸溶液中加入氢氧化钡溶液 Ba2++SO42-=BaSO4↓ |
| B、钠与水反应 Na+2H2O=Na++2OH-+H2↑ |
| C、碳酸钠溶液中加入足量盐酸 CO32-+2H+=CO2↑+H2O |
| D、铝片与硝酸汞溶液反应 Al+Hg2+=Al 3++Hg |
考点:离子方程式的书写
专题:离子反应专题
分析:A.硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水,漏掉了氢离子与氢氧根离子生成水的反应;
B.离子方程式两边电荷不守恒,违反了电荷守恒;
C.盐酸足量,碳酸钠与盐酸反应生成二氧化碳气体和水;
D.根据电荷守恒判断,离子方程式两边正电荷不相等.
B.离子方程式两边电荷不守恒,违反了电荷守恒;
C.盐酸足量,碳酸钠与盐酸反应生成二氧化碳气体和水;
D.根据电荷守恒判断,离子方程式两边正电荷不相等.
解答:
解:A.硫酸溶液中加入氢氧化钡溶液,二者反应生成硫酸钡和水,正确的离子方程式我:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故A错误;
B.钠与水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故B错误;
C.碳酸钠溶液中加入足量盐酸,反应生成二氧化碳气体和水,反应的离子方程式为:CO32-+2H+=CO2↑+H2O,故C正确;
D.铝片与硝酸汞溶液反应生成铝离子和汞单质,正确的离子方程式为:2Al+3Hg2+=2Al3++3Hg,故D错误;
故选C.
B.钠与水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故B错误;
C.碳酸钠溶液中加入足量盐酸,反应生成二氧化碳气体和水,反应的离子方程式为:CO32-+2H+=CO2↑+H2O,故C正确;
D.铝片与硝酸汞溶液反应生成铝离子和汞单质,正确的离子方程式为:2Al+3Hg2+=2Al3++3Hg,故D错误;
故选C.
点评:本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1 2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ?mol-1下列说法正确的是( )
| A、H2(g)的燃烧热△H=-285.8 kJ?mol-1 |
| B、1molH2O(l)变成1mo1H2O(g),吸收88kJ能量 |
| C、3H2(g)+CO2(g)=CH3OH(l)+H2O(l)△H=+135.9 kJ?mol-1 |
| D、可以寻找特殊催化剂使H2O分解,同时放出能量 |
将0.01molNa2SO4?10H2O 溶于水中,要使Na+离子数目与水分子数目之比为1:100,则需加入水的质量为( )克.
| A、.18 | B、.36 |
| C、34.2 | D、.37.8 |
在标准状况下,下列物质中体积最大的是( )
| A、3g H2 |
| B、1mol SO2 |
| C、36g H2O |
| D、6.02×1023个N2 |
下列表述正确的是( )
| A、H2、D2、T2互为同位素 |
| B、金属氧化物均为碱性氧化物 |
| C、质量数为131,中子数为78的碘原子常用于核反应堆的燃料棒.其核外电子数为53 |
D、S2-的结构示意图: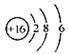 |