题目内容
下列各物质所含原子数目,按由大到小顺序排列的是( )
①0.6mol NH3
②标准状况下22.4L He
③4℃9mL水(ρ=1g/mL)
④19.6g H2SO4.
①0.6mol NH3
②标准状况下22.4L He
③4℃9mL水(ρ=1g/mL)
④19.6g H2SO4.
| A、②①③④ | B、①③④② |
| C、①④③② | D、②③④① |
考点:物质分子中的原子个数计算
专题:计算题
分析:根据n=
计算氦气物质的量,根据m=ρV计算水的质量,再根据n=
计算水的物质的量,结合每个分子含有的原子数目计算含有原子总物质的量,注意稀有气体为单原子分子,据此解答.
| V |
| Vm |
| m |
| M |
解答:
解:①0.6mol氨气含有原子物质的量=0.6mol×4=2.4mol;
②标准状况下22.4L氦气的物质的量为1mol,为单原子分子,含有原子为1mol;
③4℃时9mL水的质量为9g,其物质的量n=
=0.5mol,含有原子物质的量=0.5mol×3=1.5mol;
④19.6g H2SO4,其物质的量n=
=
=0.2mol,硫酸含有原子物质的量=0.2mol×7=1.4mol,
故含有原子数目①>③>④>②,
故选B.
②标准状况下22.4L氦气的物质的量为1mol,为单原子分子,含有原子为1mol;
③4℃时9mL水的质量为9g,其物质的量n=
| 9g |
| 18g/mol |
④19.6g H2SO4,其物质的量n=
| m |
| M |
| 19.6g |
| 98g/mol |
故含有原子数目①>③>④>②,
故选B.
点评:本题考查物质的量有关计算、微粒数目计算,比较基础,难度不大,注意理解化学式的意义.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
下列各组中的离子,能在溶液中大量共存的是( )
| A、Mg2+、H+、C1-、OH- |
| B、Na+、Ba2+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、K+、Cu2+、NO3-、SO42- |
下列分子中,含有极性键的非极性分子是( )
| A、CCl4 |
| B、NH3 |
| C、H2S |
| D、N2 |
将一定体积的密度为1.32g/cm3的硫酸溶液逐滴滴入到BaCl2溶液中,直到沉淀恰好完全为止.已知反应后所得溶液的质量等于原BaCl2溶液的质量,则原H2SO4溶液的浓度为( )
| A、21.9% |
| B、11.0% |
| C、13.5mol/L |
| D、5.67mol/L |
用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、1 mol Na2O2晶体中共含有4NA个离子 |
| B、0.1 mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| C、常温常压下16 g O2和O3混合气体含有NA个氧原子 |
| D、1 mol/L的CaCl2溶液中含Cl-的数目为2NA |
将0.01molNa2SO4?10H2O 溶于水中,要使Na+离子数目与水分子数目之比为1:100,则需加入水的质量为( )克.
| A、.18 | B、.36 |
| C、34.2 | D、.37.8 |
下列表述正确的是( )
| A、H2、D2、T2互为同位素 |
| B、金属氧化物均为碱性氧化物 |
| C、质量数为131,中子数为78的碘原子常用于核反应堆的燃料棒.其核外电子数为53 |
D、S2-的结构示意图: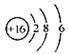 |