题目内容
下列溶液中氯离子的物质的量浓度与50mL 1mol/L的AlCl3溶液中氯离子的物质的量浓度相等的是( )
| A、75 mL 2 mol/L的CaCl2 |
| B、150 mL 3 mol/L的KCl |
| C、150 mL 1 mol/L的NaCl |
| D、75mL 2 mol/L的NH4Cl |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:离子的物质的量浓度=溶质的物质的量浓度×溶质中含有离子的个数,与溶液的体积无关.
解答:
解:50mL 1mol/L的AlCl3溶液中氯离子浓度为3mol/L.
A、75 mL 2 mol/L的CaCl2中氯离子浓度为2mol/L×2=4mol/L,故A错误;
B、150 mL 3 mol/L的KCl中氯离子浓度为3mol/L×1=3mol/L,故B正确;
C、150 mL 1 mol/L的NaCl中氯离子浓度为1mol/L,故C错误;
D、75mL 2 mol/L的NH4Cl中氯离子浓度为2mol/L×1=2mol/L,故D错误.
故选B.
A、75 mL 2 mol/L的CaCl2中氯离子浓度为2mol/L×2=4mol/L,故A错误;
B、150 mL 3 mol/L的KCl中氯离子浓度为3mol/L×1=3mol/L,故B正确;
C、150 mL 1 mol/L的NaCl中氯离子浓度为1mol/L,故C错误;
D、75mL 2 mol/L的NH4Cl中氯离子浓度为2mol/L×1=2mol/L,故D错误.
故选B.
点评:本题考查了物质的量浓度的计算,题目难度不大,明确物质的构成是解答本题的关键,并注意注意离子的浓度与溶液的体积无关,与物质的构成有关.

练习册系列答案
相关题目
下列说法正确的是( )
| A、化学反应过程都伴随着能量变化 |
| B、放热反应的发生无需任何条件 |
| C、H2SO4和NaOH的反应是吸热反应 |
| D、化学键的断裂和形成与反应放热和吸热无关 |
将一定体积的密度为1.32g/cm3的硫酸溶液逐滴滴入到BaCl2溶液中,直到沉淀恰好完全为止.已知反应后所得溶液的质量等于原BaCl2溶液的质量,则原H2SO4溶液的浓度为( )
| A、21.9% |
| B、11.0% |
| C、13.5mol/L |
| D、5.67mol/L |
用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、1 mol Na2O2晶体中共含有4NA个离子 |
| B、0.1 mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| C、常温常压下16 g O2和O3混合气体含有NA个氧原子 |
| D、1 mol/L的CaCl2溶液中含Cl-的数目为2NA |
将0.01molNa2SO4?10H2O 溶于水中,要使Na+离子数目与水分子数目之比为1:100,则需加入水的质量为( )克.
| A、.18 | B、.36 |
| C、34.2 | D、.37.8 |
下列说法正确的是( )
| A、摩尔是物质的数量单位 |
| B、氢气的摩尔质量是2g |
| C、1molNH3的质量是17g |
| D、1mol气体所占的体积约为22.4L |
下列表述正确的是( )
| A、H2、D2、T2互为同位素 |
| B、金属氧化物均为碱性氧化物 |
| C、质量数为131,中子数为78的碘原子常用于核反应堆的燃料棒.其核外电子数为53 |
D、S2-的结构示意图: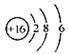 |
现有一Na2SO3、Na2SO4混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是( )
| A、将样品配制成溶液V1 L,取其中25.00mL用标准KMnO4溶液滴定,消耗标准KMnO4溶液V2 mL |
| B、向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg |
| C、将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c g |
| D、将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管Ⅰ、盛有碱石灰的干燥管Ⅱ,测定干燥管Ⅰ增重d g |