题目内容
某元素X最高价含氧酸的分子量为98,且X的氢化物的分子式是H2X,则下列说法正确的是( )
| A、X的最高化合价为+4 |
| B、X是第三周期VA族元素 |
| C、X是第三周ⅥA族元素 |
| D、X的最高价含氧酸的分子式可表示为H2XO3 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:某元素X最高价含氧酸的相对分子质量为98,则酸为硫酸或磷酸,所以X为P或S,由X的氢化物的化学式是H2X知,该化合物中X显-2价,为第VIA族元素,所以X是S元素,结合元素周期表、元素周期律来分析解答.
解答:
解:某元素X最高价含氧酸的相对分子质量为98,则酸为硫酸或磷酸,所以X为P或S,由X的氢化物的化学式是H2X知,该化合物中X显-2价,为第VIA族元素,所以X是S元素,
A.X是S元素,其最外层有6个电子,在化合物中其最高化合价是+6价,故A错误;
B.X的原子核外有3个电子层,最外层电子数是6,原子核外电子层数与其周期数相等,最外层电子数与其族序数相等,所以S位于第三周期第VIA族,故B错误;
C.根据B知,S位于第三周期第VIA族,故C正确;
D.X是S元素,最高化合价是+6价,所以X的最高价含氧酸的分子式可表示为H2XO4,故D错误;
故选C.
A.X是S元素,其最外层有6个电子,在化合物中其最高化合价是+6价,故A错误;
B.X的原子核外有3个电子层,最外层电子数是6,原子核外电子层数与其周期数相等,最外层电子数与其族序数相等,所以S位于第三周期第VIA族,故B错误;
C.根据B知,S位于第三周期第VIA族,故C正确;
D.X是S元素,最高化合价是+6价,所以X的最高价含氧酸的分子式可表示为H2XO4,故D错误;
故选C.
点评:本题考查位置、结构、性质,熟悉相对分子质量为98的酸是解答本题的关键,结合其氢化物的化合价来确定该元素,难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
下列分子中,含有极性键的非极性分子是( )
| A、CCl4 |
| B、NH3 |
| C、H2S |
| D、N2 |
将0.01molNa2SO4?10H2O 溶于水中,要使Na+离子数目与水分子数目之比为1:100,则需加入水的质量为( )克.
| A、.18 | B、.36 |
| C、34.2 | D、.37.8 |
下列表述正确的是( )
| A、H2、D2、T2互为同位素 |
| B、金属氧化物均为碱性氧化物 |
| C、质量数为131,中子数为78的碘原子常用于核反应堆的燃料棒.其核外电子数为53 |
D、S2-的结构示意图: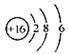 |
W、X、Y、Z、R属于短周期元素.已知它们都不是稀有气体元素,W的原子半径是所属周期中最大,X元素的原子最外层电子数为m,次外层电子数为n,Y元素的原子L层电子数为m+n,M层电子数m-n,Z元素与Y元素同主族,R元素原子与X元素原子的核外电子数之比为2:1.下列叙述中,错误的是( )
| A、分别由Y、Z组成的单质一定都为原子晶体 |
| B、W与X形成的两种化合物中阴、阳离子的个数比均为1:2 |
| C、Y、Z、R最高价氧化物对应水化物的酸性强弱顺序:R>Z>Y |
| D、X的氢化物比R的氢化物稳定,X的氢化物熔沸点比R的氢化物高 |