题目内容
9.表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题: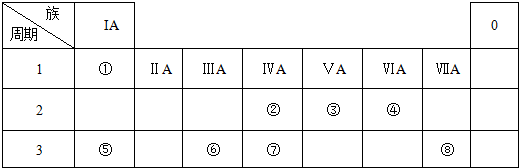
(1)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3;(用化学式表示)
(2)写出③形成的单质的结构式:N≡N;
写出②的最高价氧化物的电子式:
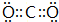 ;
;写出⑧的最高价氧化物水化物的晶体类型:分子晶体;
(3)写出工业制备⑦单质的化学方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(4)元素②和⑧的非金属性强弱,②的非金属性弱于⑧(填“强”或“弱”),并用化学方程式证明上述结论2HClO4+Na2CO3=2NaClO4+CO2↑+H2O.
分析 由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl.
(1)非金属性越强,最高价含氧酸的酸性越强;
(2)③形成的单质为N2,分子中N原子之间形成3对共用电子对;②的最高价氧化物为CO2,碳原子与氧原子之间形成2对共用电子对;⑧的最高价氧化物水化物为Cl2O7,属于分子晶体;
(3)碳与二氧化硅反应生成Si与CO;
(4)利用最高价含氧酸的酸性强弱比较.
解答 解:由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl.
(1)同周期自左而右非金属性增强、同主族自上而下非金属性减弱,非金属性越强,最高价含氧酸的酸性越强,故酸性:HNO3>H2CO3>H2SiO3,
故答案为:HNO3>H2CO3>H2SiO3;
(2)③形成的单质为N2,结构式为N≡N,②的最高价氧化物为CO2,电子式为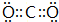 ;⑧的最高价氧化物水化物为Cl2O7,属于分子晶体,
;⑧的最高价氧化物水化物为Cl2O7,属于分子晶体,
故答案为:N≡N;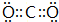 ;分子晶体;
;分子晶体;
(3)碳与二氧化硅反应生成Si与CO,反应方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(4)碳的非金属性弱于Cl元素的,可以利用最高价含氧酸中强酸制备弱酸证明,反应方程式:2HClO4+Na2CO3=2NaClO4+CO2↑+H2O,
故答案为:2HClO4+Na2CO3=2NaClO4+CO2↑+H2O.
点评 本题考查元素周期表与元素周期律综合应用,熟练掌握元素周期表的结构,掌握金属性、非金属性强弱比较实验事实.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
19.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 25℃时,100mLPH=1的CH3COOH溶液中含有的H+总数大于0.01NA | |
| B. | 标准状况下,11g3H216O种含有的质子数为6NA | |
| C. | 1molLi2O和Na2O2的混合物中含有的离子总数为3NA | |
| D. | 1molN2与足量H2混合,充分反映后转移电子数为6NA |
17.2L0.1moI/L的NaCl溶液中,含溶质NaCl的物质的量是﹙)
| A. | 0.2 mol | B. | 0.5 mol | C. | 2 mol | D. | 5 mol |
19.苯环和侧链相互影响,下列关于甲苯的实验事实中,能说明苯环对侧链有影响的是( )
| A. | 甲苯能与浓硝酸浓硫酸反应生成三硝基甲苯 | |
| B. | 1 mol甲苯能与3 mol H2发生加成反应 | |
| C. | 甲苯能使酸性高锰酸钾褪色 | |
| D. | 甲苯能燃烧产生带浓烟的火焰 |
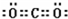 ;E的单质在空气中燃烧所生成物质的化学式SO2.
;E的单质在空气中燃烧所生成物质的化学式SO2.