题目内容
4.写出下列物质的电离方程式.(1)熔融状态下NaHSO4的电离:NaHSO4=Na++HSO4-
(2)H2CO3的电离:H2CO3?HCO3-+H+,HCO3-?H++CO32-
(3)Fe(OH)3的电离:Fe(OH)3?Fe3++3OH-
(4)水溶液中NaHSO4的电离:NaHSO4=Na++H++SO42-,.
分析 (1)熔融状态下NaHSO4的电离出钠离子和硫酸氢根离子;
(2)H2CO3的分步可逆电离;
(3)氢氧化铁为弱碱,可逆电离但一步写;
(4)NaHSO4是强电解质,NaHSO4在水中电离出钠离子和硫酸根离子和氢离子.
解答 解(1)熔融状态下NaHSO4的电离出钠离子和硫酸氢根离子,电离方程式为NaHSO4=Na++HSO4-,故答案为:NaHSO4=Na++HSO4-;
(2)H2CO3的分步可逆电离,电离方程式为H2CO3?HCO3-+H+,HCO3-?H++CO32-,故答案为:H2CO3?HCO3-+H+,HCO3-?H++CO32-;
(3)氢氧化铁为弱碱,可逆电离出铁离子和氢氧根离子,但可一步写,电离方程式为Fe(OH)3?Fe3++3OH-,故答案为:Fe(OH)3?Fe3++3OH-;
(4)NaHSO4是强酸强碱酸式盐,属强电解质,完全电离,电离出Na+、H+、SO42-离子,电离方程式为:NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-.
点评 本题考查电离方程式的书写,明确电解质的强弱及常见的酸根离子,并利用电荷守恒是解答关键,题目难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
14.下列有机物的命名中,正确的是( )
| A. | 4甲基4,5二乙基己烷 | B. | 2,3-二甲基-2,4-戊二烯 | ||
| C. | CH3CH(OH)CH2CH3:丁醇 | D. | 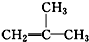 :2-甲基-1-丙烯 :2-甲基-1-丙烯 |
19.化学与生产生活、环境保护、资源利用、能源开发等密切相关.下列说法错误的是( )
| A. | 积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 | |
| B. | 减少机动车尾气的排放,可以降低雾霾的发生 | |
| C. | 利用生物方法脱除生活污水中的氮和磷,可防止水体富营养化 | |
| D. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 |
16.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.CO可用于炼铁,
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1;则CO还原Fe2O3(s)的热化学方程式为( )
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1;则CO还原Fe2O3(s)的热化学方程式为( )
| A. | Fe2O3+3CO=2Fe+3CO2△H=-28.5kJ•mol-1( ) | |
| B. | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ | |
| C. | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=+28.5kJ•mol-1 | |
| D. | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1. |
13.某主族元素原子,其M能层上有一个半充满的能级,该原子的质子数( )
| A. | 只能是11 | B. | 只能是24 | C. | 可能是29 | D. | 可能是11或15 |
 苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为:
苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为: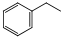 (g)$?_{高温(T)}^{Fe_{2}O_{3}}$
(g)$?_{高温(T)}^{Fe_{2}O_{3}}$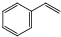 (g)+H2(g)△H=+120kJ•mol-1
(g)+H2(g)△H=+120kJ•mol-1
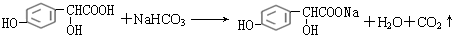 .
. .
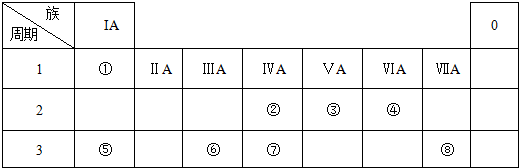
.
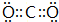 ;
;