题目内容
19.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 25℃时,100mLPH=1的CH3COOH溶液中含有的H+总数大于0.01NA | |
| B. | 标准状况下,11g3H216O种含有的质子数为6NA | |
| C. | 1molLi2O和Na2O2的混合物中含有的离子总数为3NA | |
| D. | 1molN2与足量H2混合,充分反映后转移电子数为6NA |
分析 A、pH=1的醋酸溶液中,氢离子的浓度为0.1mol/L;
B、3H216O的摩尔质量为22g/mol;
C、Li2O和Na2O2均由2个阳离子和1个阴离子构成;
D、氮气和氢气的反应为可逆反应.
解答 解:A、pH=1的醋酸溶液中,氢离子的浓度为0.1mol/L,故100mL溶液中的氢离子的物质的量n=CV=0.1mol/L×0.1L=0.01mol,个数为0.01NA个,故A错误;
B、3H216O的摩尔质量为22g/mol,故11g3H216O的物质的量n=$\frac{11g}{22g/mol}$=0.5mol,故含5NA个质子,故B错误;
C、Li2O和Na2O2均由2个阳离子和1个阴离子构成,故1mol混合物中含3NA个离子,故C正确;
D、氮气和氢气的反应为可逆反应,故不能反应完全,则转移的电子数小于6NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
15.在密闭容器中进行的可逆反应2X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别0.1mol•L-1、0.2mol•L-1、0.2mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度可能( )
| A. | Z为0.3 mol•L-1 | B. | Y2为0.1 mol•L-1 | C. | X2为0.2 mol•L-1 | D. | Z为0.4 mol•L-1 |
7.为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
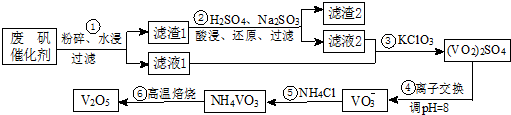
部分含钒物质在水中的溶解性见表.回答下列问题:
(1)工业上用铝热剂法由V2O5冶炼金属钒的化学方程式为3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
(2)滤渣1中含矾的物质被Na2SO3还原的离子方程式为V2O5+SO32-+4H+═2VO2++SO42-+2H2O;
请配平滤液2中VOSO4被KClO3氧化的化学方程式:6VOSO4+KClO3+3H2O═3(VO2)2SO4
+KCl+3H2SO4.
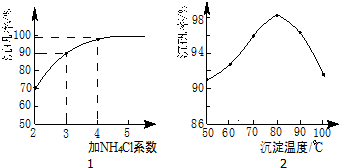
(3)步骤⑤沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中
V2O5的质量比)和温度.根据图判断沉矾最佳控制氯化铵系数和温度分别为4、80℃;从平
衡移动角度解释沉矾过程中控制n(NH4+):n(VO3-)>1:1,原因是增大铵根离子浓度,可以提高VO3-转化率,以保证VO3-沉淀完全.
(4)步骤⑥反应的化学方程式为2NH4VO3$\frac{\underline{\;\;△\;\;}}{\;}$V2O5+2NH3↑+H2O.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:
VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+;
若用放电的电流强度I=2.0A,电池工作10分钟,电解精炼铜得到铜mg,则电流利用效率为$\frac{965}{384}$m×100%(写出表达式,不必计算出结果.已知:电量Q=It,t为时间秒;电解时Q=znF,$电流利用效率=\frac{负载利用电量}{电池输出电量}×100%$
z为每摩尔物质得失电子数、法拉第常数F=96500C/mol,).

部分含钒物质在水中的溶解性见表.回答下列问题:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(2)滤渣1中含矾的物质被Na2SO3还原的离子方程式为V2O5+SO32-+4H+═2VO2++SO42-+2H2O;
请配平滤液2中VOSO4被KClO3氧化的化学方程式:6VOSO4+KClO3+3H2O═3(VO2)2SO4
+KCl+3H2SO4.
(3)步骤⑤沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中
V2O5的质量比)和温度.根据图判断沉矾最佳控制氯化铵系数和温度分别为4、80℃;从平
衡移动角度解释沉矾过程中控制n(NH4+):n(VO3-)>1:1,原因是增大铵根离子浓度,可以提高VO3-转化率,以保证VO3-沉淀完全.
(4)步骤⑥反应的化学方程式为2NH4VO3$\frac{\underline{\;\;△\;\;}}{\;}$V2O5+2NH3↑+H2O.

(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:
VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+;
若用放电的电流强度I=2.0A,电池工作10分钟,电解精炼铜得到铜mg,则电流利用效率为$\frac{965}{384}$m×100%(写出表达式,不必计算出结果.已知:电量Q=It,t为时间秒;电解时Q=znF,$电流利用效率=\frac{负载利用电量}{电池输出电量}×100%$
z为每摩尔物质得失电子数、法拉第常数F=96500C/mol,).
14.下列有机物的命名中,正确的是( )
| A. | 4甲基4,5二乙基己烷 | B. | 2,3-二甲基-2,4-戊二烯 | ||
| C. | CH3CH(OH)CH2CH3:丁醇 | D. | 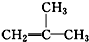 :2-甲基-1-丙烯 :2-甲基-1-丙烯 |
4.对某含铜矿石【主要成分xCuCO3•yCu(OH)2•zCuSiO3,含少量SiO3,FeCO3】进行处理的流程如下:
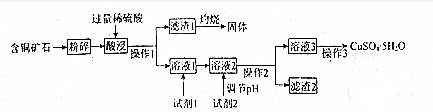
已知:ⅰ.试剂价格:漂液(含25.2%NaClO)450元/吨,双氧水(含30%H2O2)2400元/吨.
ⅱ.溶液中离子浓度小于等于1.0×10-5mol•L-1时,认为该离子沉淀完全.
ⅲ.25℃时,金属离子生成氢氧化物时,开始沉淀和沉淀完全的pH如表所示,
请回答:
(1)含铜矿石粉碎的目的为增大矿石与稀硫酸的接触面积,加快酸浸速率并使酸浸更充分,滤渣Ⅰ灼烧所得固体的用途为制备光导纤维、制备玻璃、生产硅单质等(任写一种).
(2)操作Ⅰ所用的玻璃仪器为烧杯、漏斗、玻璃棒.
(3)试剂1的名称为漂液,选择该试剂的理由为节约成本,所发生反应的离子方程式为ClO-+2Fe2++2H+=Cl-+2Fe3++H2O.
(4)加入试剂2,需调节溶液的pH的合理范围为3.7≤PH<4.0,试剂2可以选择下列物质中的BC(填选项字母).
A.Cu B.CuO C.Cu(OH)2 D.Fe
(5)操作3包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥、洗涤的方法为用玻璃棒引流向过滤器中加入冷水至浸没沉淀,待水自然流下,重复2-3次.
(6)25℃时,Cu(OH)2 的溶度积常数K溶[Cu(OH)2]=1.0×10-20.

已知:ⅰ.试剂价格:漂液(含25.2%NaClO)450元/吨,双氧水(含30%H2O2)2400元/吨.
ⅱ.溶液中离子浓度小于等于1.0×10-5mol•L-1时,认为该离子沉淀完全.
ⅲ.25℃时,金属离子生成氢氧化物时,开始沉淀和沉淀完全的pH如表所示,
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.0 | 6.5 |
(1)含铜矿石粉碎的目的为增大矿石与稀硫酸的接触面积,加快酸浸速率并使酸浸更充分,滤渣Ⅰ灼烧所得固体的用途为制备光导纤维、制备玻璃、生产硅单质等(任写一种).
(2)操作Ⅰ所用的玻璃仪器为烧杯、漏斗、玻璃棒.
(3)试剂1的名称为漂液,选择该试剂的理由为节约成本,所发生反应的离子方程式为ClO-+2Fe2++2H+=Cl-+2Fe3++H2O.
(4)加入试剂2,需调节溶液的pH的合理范围为3.7≤PH<4.0,试剂2可以选择下列物质中的BC(填选项字母).
A.Cu B.CuO C.Cu(OH)2 D.Fe
(5)操作3包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥、洗涤的方法为用玻璃棒引流向过滤器中加入冷水至浸没沉淀,待水自然流下,重复2-3次.
(6)25℃时,Cu(OH)2 的溶度积常数K溶[Cu(OH)2]=1.0×10-20.
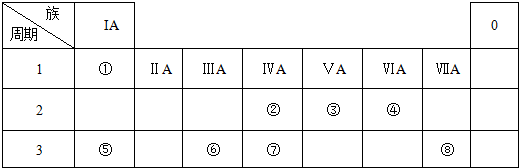
11.表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:⑥Si⑪Ca.
(2)在这些元素中,最活泼的金属元素和最活泼的非金属元素分别是K、F(用元素符号作答).
(3)在这些元素的最高价氧化物对应水化物中,有一种呈两性的用来治疗胃酸过多反应的化学方程式:Al(OH)3+3HCl=AlCl3+3H2O.
(4)在这些元素中,某元素的最高价氧化物对应的水化物可以和其气态氢化物反应,写出该方程式NH3+HNO3=NH4NO3或 H2S+3H2SO4(浓)=4SO2+4H2O.
(5)在⑤与④中,设计简单的实验(只要写出实验方案即可),证明其金属性的强弱,方案分别取大小和形状相同的Mg和Al与浓度相同的盐酸反应,观察产生气泡的速率,比较快的是Mg,故Mg金属性强;
(6)如何元素⑦与⑧的非金属性强弱,写出可以验证该结论的一个离子反应方程式S2-+Cl2=S↓+2Cl-.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素中,最活泼的金属元素和最活泼的非金属元素分别是K、F(用元素符号作答).
(3)在这些元素的最高价氧化物对应水化物中,有一种呈两性的用来治疗胃酸过多反应的化学方程式:Al(OH)3+3HCl=AlCl3+3H2O.
(4)在这些元素中,某元素的最高价氧化物对应的水化物可以和其气态氢化物反应,写出该方程式NH3+HNO3=NH4NO3或 H2S+3H2SO4(浓)=4SO2+4H2O.
(5)在⑤与④中,设计简单的实验(只要写出实验方案即可),证明其金属性的强弱,方案分别取大小和形状相同的Mg和Al与浓度相同的盐酸反应,观察产生气泡的速率,比较快的是Mg,故Mg金属性强;
(6)如何元素⑦与⑧的非金属性强弱,写出可以验证该结论的一个离子反应方程式S2-+Cl2=S↓+2Cl-.
8.下列说法正确的是( )
| A. | H2O(g)=H2O(l)△H=-44kJ/mol,所以该过程是放热反应 | |
| B. | 人类利用的能源都是通过化学反应获得的 | |
| C. | 2CO(g)+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2(g)△H<0,则56gCO和32gO2所具有的总能里大于88g所具有的总能量 | |
| D. | 需要加热的反应一定是吸热反应 |
 ;
;