题目内容
19.苯环和侧链相互影响,下列关于甲苯的实验事实中,能说明苯环对侧链有影响的是( )| A. | 甲苯能与浓硝酸浓硫酸反应生成三硝基甲苯 | |
| B. | 1 mol甲苯能与3 mol H2发生加成反应 | |
| C. | 甲苯能使酸性高锰酸钾褪色 | |
| D. | 甲苯能燃烧产生带浓烟的火焰 |
分析 甲苯和苯相比,甲苯中比苯多一个甲基,甲基的结够和烷烃相似,所以甲基应具有烷烃的性质;根据苯环和侧链相互影响知,只要甲基能发生的化学反应烷烃不能发生,即可说明苯环对侧链有影响.
解答 解:A.甲苯和苯都能与浓硝酸、浓硫酸发生取代反应,所以不能说明苯环对侧链有影响,故A错误;
B.1mol甲苯或1mol苯都能与3molH2发生加成反应,所以不能说明苯环对侧链有影响,故B错误;
C.甲苯能使酸性高锰酸钾褪色,苯不能使酸性高锰酸钾褪色,所以能说明苯环对侧链有影响,故C正确;
D.苯和甲苯都能燃烧产生带浓烟的火焰,这是碳不完全燃烧导致,所以不能说明苯环对侧链有影响,故D错误;
故选C.
点评 本题考查有机物中官能团及性质,为高频考点,把握发生的反应及苯环对侧链的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下列说法正确的是( )
| A. | KOH和CaCl2既含有离子键,又含有共价键 | |
| B. | PH3各原子均满足8电子稳定结构 | |
| C. | 硫离子的结构示意图: | |
| D. | NH4Cl的电子式: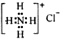 |
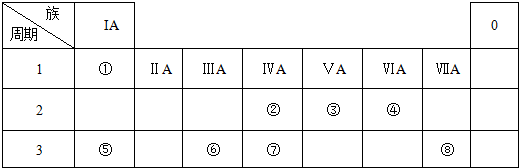
7.下表为元素周期表的一部分,请回答有关问题:
(1)⑤和⑧的元素符号是Si和Ar;
(2)表中最活泼的金属元素是K,非金属性最强的元素是F(用元素符号填写);
(3)写出⑦和⑨形成的化合物的电子式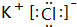
(4)①的氢化物与⑦的氢化物能够发生反应,写成形成盐M的电子式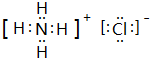 ,M中的化学键类型为离子键、共价键.
,M中的化学键类型为离子键、共价键.
(5)表中形成两性氢氧化物的元素是Al(用元素符号填写),写出该元素的氢氧化物分别与⑥、⑨的最高价氧化物对应水化物反应的离子方程式:Al(OH)3+3H+═Al3++3H2O,Al(OH)3+OH-═AlO2-+2H2O.
| I A | IIA | ⅢA | IVA | VA | ⅥA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属元素是K,非金属性最强的元素是F(用元素符号填写);
(3)写出⑦和⑨形成的化合物的电子式
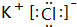
(4)①的氢化物与⑦的氢化物能够发生反应,写成形成盐M的电子式
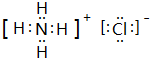 ,M中的化学键类型为离子键、共价键.
,M中的化学键类型为离子键、共价键.(5)表中形成两性氢氧化物的元素是Al(用元素符号填写),写出该元素的氢氧化物分别与⑥、⑨的最高价氧化物对应水化物反应的离子方程式:Al(OH)3+3H+═Al3++3H2O,Al(OH)3+OH-═AlO2-+2H2O.
4.同周期的三种元素X、Y、Z,已知最高价氧化物的水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断正确的是( )
| A. | 非金属性 Z>Y>X | B. | 原子半径 X>Y>Z | ||
| C. | 气态氢化物的稳定性 X>Y>Z | D. | 原子最外层电子数Z>Y>X |
11.下列化学用语正确的是( )
| A. | HCl的电子式 | B. | Cl-的结构示意图 | ||
| C. | CO2的电子式 | D. | 质量数为37的氯原子37Cl |
8.短周期元素Q、W、X、Y、Z在元素周期表中的对应位置如图所示,其中只有Z为金属元素.下列说法正确的是( )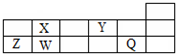

| A. | W、X两元素在自然界中都存在相应的单质 | |
| B. | Q、Y分别与钠元素形成的化合物中仅含离子键 | |
| C. | 简单离子半径由大到小的顺序为:Q>Y>Z | |
| D. | X、Z的最高价氧化物对应的水化物之间易发生化学反应 |
9. 某学生利用物质间的互变,设计成一个平面魔方,如图所示:
某学生利用物质间的互变,设计成一个平面魔方,如图所示:
已知:
①A、B、C、D、G含有同种元素.
②E 是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀.B具有氧化性,液显黄色,能将SO2氧化为F(H2SO4),F与A反应生成E、G.
③
依据以上信息填空:
(1)请写出E的电子式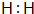 .
.
(2)D的化学式Fe2O3.
(3)请写出ABCDG所含的同种元素的原子结构示意图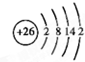 .
.
(4)G生成C的过程中所出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色
(5)写出A→B化学方程式:2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3
(6)B→F的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
 某学生利用物质间的互变,设计成一个平面魔方,如图所示:
某学生利用物质间的互变,设计成一个平面魔方,如图所示:已知:
①A、B、C、D、G含有同种元素.
②E 是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀.B具有氧化性,液显黄色,能将SO2氧化为F(H2SO4),F与A反应生成E、G.
③
| 纯A(单质) | B溶液 | C固体 | D固体 | G溶液 |
| 颜色 | 银白色(粉末状时为黑色)黄色红 | 褐色 | 红棕色 | 浅绿色 |
(1)请写出E的电子式
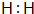 .
.(2)D的化学式Fe2O3.
(3)请写出ABCDG所含的同种元素的原子结构示意图
 .
.(4)G生成C的过程中所出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色
(5)写出A→B化学方程式:2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3
(6)B→F的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
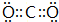 ;
;