题目内容
4.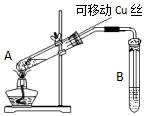 在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )
在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )| A. | 0.25mol•L-1 | B. | 0.5mol•L-1 | C. | 0.025mol•L-1 | D. | 0.05mol•L-1 |
分析 根据铜的物质的量及溶液体积结合c=$\frac{n}{V}$计算出反应后溶液中Cu2+物质的量浓度.
解答 解:反应前铜为8.0g,反应后剩余4.8g铜,反应消耗了8.0g-4.8g=3.2g铜,根据质量守恒,溶液中铜离子的浓度为:c=$\frac{n}{V}$=$\frac{\frac{3.2g}{64g/mol}}{0.1L}$=0.5mol/L,
故选:B.
点评 本题考查了浓硫酸的性质、有关物质的量的简单计算,题目难度中等,明确物质的量浓度的概念及计算方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.用NA表示阿佛加德罗常数,下列说法正确的是( )
| A. | 2.4g金属镁变成镁离子时失去的电子数目为0.1NA | |
| B. | 标准状况下,2.24LBr2所含的分子数为0.1NA | |
| C. | 室温下,32gO2和O3的混合气体中含有的氧原子数为2NA | |
| D. | 1.0mol•L-1的Na2CO3溶液中含有的Na+离子数目为2NA |
19.有溶质的物质的量浓度均为0.1mol/L的下列八种溶液①HCl ②H2SO4 ③CH3COOH④Ba(OH)2 ⑤KOH ⑥NaF ⑦KCl ⑧NH4Cl 这些溶液的pH由小到大的顺序是( )
| A. | ②①③⑧⑦⑥⑤④ | B. | ②①③⑥⑦⑧⑤④ | C. | ①②③⑧⑦⑥④⑤ | D. | ②①⑧③⑦⑥④⑤ |
9.8g无水硫酸铜配成0.1mol•L-1的水溶液.下列说法正确的是( )
| A. | 溶于500 mL水中 | B. | 溶于1 L水中 | ||
| C. | 溶解后溶液的总体积为500 mL | D. | 溶解后溶液的总体积为1 L |
16.下列试剂常用来检验Fe3+的是( )
| A. | 氯水 | B. | BaCl2溶液 | C. | KSCN溶液 | D. | KNO3溶液 |
13.下列溶液对水的电离平衡不产生影响的是( )
| A. | NaHSO4溶液 | B. | KOH溶液 | C. | Na2SO4 | D. | NH4Cl溶液 |
14.在一定温度下,向一容积不变的密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )
| A. | 容器内压强不随时间变化 | B. | 化学反应速率关系是:2υ正(X)=υ正(Y) | ||
| C. | 容器内气体密度不随时间变化 | D. | 容器内X、Y、Z的浓度之比为l:2:2 |
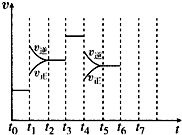 在一密闭容器中发生反应N2+3H2 2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2 2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示: