题目内容
19.有溶质的物质的量浓度均为0.1mol/L的下列八种溶液①HCl ②H2SO4 ③CH3COOH④Ba(OH)2 ⑤KOH ⑥NaF ⑦KCl ⑧NH4Cl 这些溶液的pH由小到大的顺序是( )| A. | ②①③⑧⑦⑥⑤④ | B. | ②①③⑥⑦⑧⑤④ | C. | ①②③⑧⑦⑥④⑤ | D. | ②①⑧③⑦⑥④⑤ |
分析 酸性溶液的pH<7、中性溶液的pH=7、碱性溶液的pH>7,且酸性越强,溶液的pH越小,碱性越强,溶液的pH越大;先根据溶液酸碱性对各物质进行分类,然后根据电解质的电离,盐的水解程度大小判断溶液中氢离子、氢氧根离子浓度,再判断溶液pH大小.
解答 解:酸性溶液:①HCl为一元强酸;
②H2SO4为二元强酸;
③CH3COOH为一元弱酸;
⑧NH4Cl溶液中,铵根离子水解,溶液显示酸性;
所以溶液的pH由小到大的顺序:②①③⑧;
碱性溶液:
④Ba(OH)2为二元强碱;
⑤KOH为一元强碱;
⑥NaF为强碱弱酸盐,溶液显示碱性;
所以溶液的pH由小到大的顺序:⑥⑤④;
⑦KCl是强酸强碱盐,其溶液呈中性;
通过以上分析知,这几种溶液的pH由小到大的排列顺序是:②①③⑧⑦⑥⑤④,
故选A.
点评 本题考查了弱电解质的电离及盐类水解,题目难度不大,根据“谁强谁显性、谁弱谁水解、强强显中性”确定盐溶液酸碱性,从而确定溶液pH大小.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
3.若溶液中由水电离产生的c (OH-)=1×10-13mol/L,满足此条件的溶液中一定可以大量共存的离子组是( )
| A. | Al3+,Na+,NO3-,Cl- | B. | K+,Na+,Cl-,NO3- | ||
| C. | K+,Na+,Cl-,AlO2- | D. | K+,NH4+,SO42-,NO3- |
14.在容积不变的密闭容器中,在一定条件下发生反应2A(?)═B(g)+C(s),达到化学平衡后,其他条件不变,升高温度时,容器内气体的密度增大,则下列叙述正确的是( )
| A. | 若正反应是吸热反应,则A为气态 | |
| B. | 若正反应是放热反应,则A为气态 | |
| C. | 改变压强对平衡的移动无影响 | |
| D. | 在平衡体系中加入少量C,则平衡向逆反应方向移动 |
4.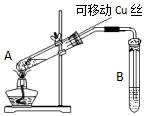 在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )
在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )
 在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )
在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )| A. | 0.25mol•L-1 | B. | 0.5mol•L-1 | C. | 0.025mol•L-1 | D. | 0.05mol•L-1 |
11.一定条件下2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1;CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1,则1molCO和3molCH4组成的混合气体在上述条件下完全燃烧放出的热量为( )
| A. | 2912 kJ | B. | 2953 kJ | C. | 3236 kJ | D. | 3836 kJ |
8.在同温同压下,A容器中的氧气(O2)和B容器中的氨气(NH3)所含的原子个数相同,则A、B两容器中气体的体积之比是( )
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 无法比较 |
9.某无色溶液中可能含有下列离子中的某几种:K+、Cl-、SO42-、CO32-、NH4+、Na+.为确认溶液组成进行如下实验( )
①200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g.若向该沉淀中加入过量的盐酸,仍有2.33g沉淀不溶.
②向①的滤液中加入足量的KOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体0.672L(已换算成标准状况,假定产生的气体全部逸出).
③将②溶液进行焰色反应实验,透过蓝色的钴玻璃看到了紫色火焰.
①200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g.若向该沉淀中加入过量的盐酸,仍有2.33g沉淀不溶.
②向①的滤液中加入足量的KOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体0.672L(已换算成标准状况,假定产生的气体全部逸出).
③将②溶液进行焰色反应实验,透过蓝色的钴玻璃看到了紫色火焰.
| A. | 一定存在K+、SO42-、CO32-、NH4+,可能存在Na+、Cl- | |
| B. | 一定存在K+、SO42-、CO32-、NH4+,一定不存在Cl-、Na+ | |
| C. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Na+,一定不存在Cl- | |
| D. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Na+、Cl- |
