题目内容
12.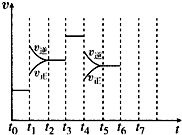 在一密闭容器中发生反应N2+3H2 2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2 2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
(1)t1、t3、t4时刻分别改变的一个条件是CEB(填选项).
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻C;
(2)依据(1)中的结论,下列时间段中,氨的百分含量最高的是A(填选项).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6.
分析 (1)由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率;t3反应速率加快,但化学平衡不移动;t4时正逆反应速率均减小,且逆反应速率大于正反应速率;根据平衡化学平衡的因素分析;
(2)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,根据移动结果分析.
解答 解:(1)由N2(g)+3H2(g)?2NH3(g)△H<0,可知,该反应为放热反应,且为气体体积减小的反应,则由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率,改变条件应为升高温度;t3反应速率加快,但化学平衡不移动,改变条件应为加催化剂;t4时正逆反应速率均减小,且逆反应速率大于正反应速率,改变条件应为减小压强,;
故答案为:CEB;C;
(2)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,均使氨气的含量减少,则t0~t1氨气的含量最大;
故答案为:A.
点评 本题考查影响化学反应速率的因素,注意把握反应的特点及图象分析是解答的关键,明确温度、压强、催化剂对反应速率的影响即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 32 g O2气体含有的氧原子数为NA | |
| B. | 2 L 0.3 mol/L Na2SO4溶液中含有Na+为0.6NA | |
| C. | 54 g铝完全反应后失去的电子数为6NA | |
| D. | 11.2 L氮气所含的分子数为0.5NA |
3. 氮可形成多种氧化物,如NO、NO2、N2O4等.
氮可形成多种氧化物,如NO、NO2、N2O4等.
(1)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH═NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与 0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的 CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-)(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L).可使溶液A和溶液B的pH相等的方法是bc.
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(2)100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g)?N2O4(g)△H<0.每隔一定时间就对该容器内的物质进行分析,得到如表所示数据.
在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为0.15mol/(L•min),n3=n4(填“>”“<”或“=”),该反应的平衡常数的值为2.8.若在相同条件下,最初向该容器充入的是N2O4气体,达到上述同样的平衡状态,则N2O4的起始浓度是0.1mol/L;假设从放入N2O4到平衡时需要80s,则达到平衡时四氧化二氮的转化率为60%.
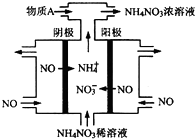
(3)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是NH3,理由是根据反应:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3,电解产生的硝酸多,需补充NH3.
 氮可形成多种氧化物,如NO、NO2、N2O4等.
氮可形成多种氧化物,如NO、NO2、N2O4等.(1)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH═NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与 0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的 CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-)(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L).可使溶液A和溶液B的pH相等的方法是bc.
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(2)100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g)?N2O4(g)△H<0.每隔一定时间就对该容器内的物质进行分析,得到如表所示数据.
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(3)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是NH3,理由是根据反应:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3,电解产生的硝酸多,需补充NH3.
17.以苯为原料,不能通过一步反应制得的有机物是( )
| A. | 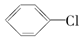 | B. | 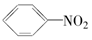 | C. | 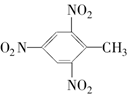 | D. |  |
4.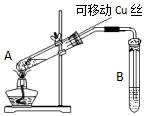 在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )
在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )
 在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )
在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )| A. | 0.25mol•L-1 | B. | 0.5mol•L-1 | C. | 0.025mol•L-1 | D. | 0.05mol•L-1 |
1.常温下,向一定体积的0.1mol/L的醋酸溶液中加水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目减少 | |
| B. | 醋酸的电离程度增大,c(H+)亦增大 | |
| C. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$不变 | |
| D. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 |
2.2016年是“十三五”的开局之年,4月22日是第47个世界地球日,我国今年的地球日主题确定为“节约集约利用资源,倡导绿色简约生活”,下列做法与此主题不相符的是( )
| A. | 传统的节日和纪念日,从中央到地方都应该多举办形式华丽、场面壮观的大型庆典活动,贫困地区可以靠拉赞助、贷款、摊派等形式筹集相关费用 | |
| B. | 不囤东西,不买便宜次品货,确有必要的东西,买好的,并充分使用它 | |
| C. | 精简银行卡,仅保留一张借记卡一张信用卡 | |
| D. | 用电脑写东西,少用纸,养成纸质文件扫描、存档的习惯 |
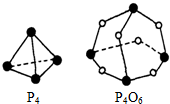 白磷(P4)和P4O6的分子结构如图.现提供以下化学键的键能:P-P为E1kJ•mol-1、P-O为E2kJ•mol-1、O=O为E3 kJ•mol-1.则:P4(s)+3O2(g)═P4O6(s)的反应热△H=kJ•mol-1(6E1+3E3-12E2)kJ•mol-1(用E1,E2,E3表示).
白磷(P4)和P4O6的分子结构如图.现提供以下化学键的键能:P-P为E1kJ•mol-1、P-O为E2kJ•mol-1、O=O为E3 kJ•mol-1.则:P4(s)+3O2(g)═P4O6(s)的反应热△H=kJ•mol-1(6E1+3E3-12E2)kJ•mol-1(用E1,E2,E3表示).