题目内容
15.研究表明,化学反应的焓变与反应物和生成物的键能有关.所谓键能就是:在101.3kPa、298K时,断开1mol气态AB为气态A、气态B时过程的焓变,用△H298(AB)表示;断开化学键时△H>0[如H2(g)═2H(g)△H=+436kJ•mol-1],形成化学键时△H<0[如2H(g)═H2(g)△H=-436kJ•mol-1].已知:H2(g)+Cl2(g)═2HCl(g)△H=-185kJ•mol-1
△H298(H2)=+436kJ•mol-1,△H298(Cl2)=+247kJ•mol-1
则△H298(HCl)=+434KJ/mol.
分析 热化学方程式中,反应焓变△H=反应物化学键总键能-生成物总键能,据此列式计算.
解答 解:已知H2(g)+Cl2(g)═2HCl(g)△H=-185kJ•mol-1
△H298(H2)=+436kJ•mol-1,△H298(Cl2)=+247kJ•mol-1
则△H=△H298(H2)+△H298(Cl2)-2×△H298(HCl)=-185kJ•mol-1
所以△H298(HCl)=$\frac{1}{2}$(△H298(H2)+△H298(Cl2)+185KJ/mol)=+434KJ/mol,
故答案为:+434KJ/mol.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确“焓变△H=反应物化学键总键能-生成物总键能”为解答关键,试题有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,48gO3含有的氧原子数为3NA | |
| B. | 1 mol OH-所含的电子数为9NA | |
| C. | 常温常压下,11.2 L氧气所含的原子数为NA | |
| D. | 物质的量浓度为1mol/L MgCl2溶液,含有Cl-离子数为2NA |
20.可逆反应A(g)+3B(g)?2C(g)△H=-QkJ/mol.有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2molC达到平衡后吸收热量为Q2 kJ;已知Q1=3Q2.下列叙述正确的是( )
| A. | 乙中C的转化率为75% | |
| B. | 反应.达到平衡前,甲中始终有V正>V逆,乙中始终有V正<V逆 | |
| C. | 在该条件下,反应2C(g)?A(g)+3B(g)的平衡常数为2.7×1.54 | |
| D. | 乙中的热化学方程式为2C(g))?A(g)+3B(g)△H=+Q2kJ/mol |
3.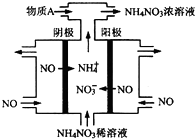 氮可形成多种氧化物,如NO、NO2、N2O4等.
氮可形成多种氧化物,如NO、NO2、N2O4等.
(1)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH═NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与 0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的 CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-)(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L).可使溶液A和溶液B的pH相等的方法是bc.
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(2)100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g)?N2O4(g)△H<0.每隔一定时间就对该容器内的物质进行分析,得到如表所示数据.
在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为0.15mol/(L•min),n3=n4(填“>”“<”或“=”),该反应的平衡常数的值为2.8.若在相同条件下,最初向该容器充入的是N2O4气体,达到上述同样的平衡状态,则N2O4的起始浓度是0.1mol/L;假设从放入N2O4到平衡时需要80s,则达到平衡时四氧化二氮的转化率为60%.
(3)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是NH3,理由是根据反应:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3,电解产生的硝酸多,需补充NH3.
 氮可形成多种氧化物,如NO、NO2、N2O4等.
氮可形成多种氧化物,如NO、NO2、N2O4等.(1)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH═NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与 0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的 CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-)(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L).可使溶液A和溶液B的pH相等的方法是bc.
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(2)100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g)?N2O4(g)△H<0.每隔一定时间就对该容器内的物质进行分析,得到如表所示数据.
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(3)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是NH3,理由是根据反应:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3,电解产生的硝酸多,需补充NH3.
4.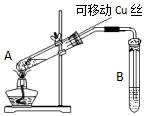 在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )
在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )
 在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )
在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )| A. | 0.25mol•L-1 | B. | 0.5mol•L-1 | C. | 0.025mol•L-1 | D. | 0.05mol•L-1 |
5.下列有机物检验方法正确的是( )
| A. | 取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤原子存在 | |
| B. | 苯和乙烯都能使溴水褪色,但褪色的原理是不同的 | |
| C. | 用溴水可以鉴别乙烯与乙炔 | |
| D. | 苯和苯的同系物都可以用酸性高锰酸钾溶液鉴别 |

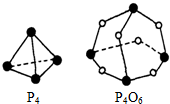 白磷(P4)和P4O6的分子结构如图.现提供以下化学键的键能:P-P为E1kJ•mol-1、P-O为E2kJ•mol-1、O=O为E3 kJ•mol-1.则:P4(s)+3O2(g)═P4O6(s)的反应热△H=kJ•mol-1(6E1+3E3-12E2)kJ•mol-1(用E1,E2,E3表示).
白磷(P4)和P4O6的分子结构如图.现提供以下化学键的键能:P-P为E1kJ•mol-1、P-O为E2kJ•mol-1、O=O为E3 kJ•mol-1.则:P4(s)+3O2(g)═P4O6(s)的反应热△H=kJ•mol-1(6E1+3E3-12E2)kJ•mol-1(用E1,E2,E3表示).