题目内容
9.8g无水硫酸铜配成0.1mol•L-1的水溶液.下列说法正确的是( )| A. | 溶于500 mL水中 | B. | 溶于1 L水中 | ||
| C. | 溶解后溶液的总体积为500 mL | D. | 溶解后溶液的总体积为1 L |
分析 8g无水硫酸铜的物质的量为:n(CuSO4)=$\frac{8g}{160g/mol}$=0.05mol,配制0.1mol/L硫酸铜溶液,所配制的溶液体积为:$\frac{0.05mol}{0.1mol/L}$=0.5L=500mL,以此解答该题.
解答 解:8g无水硫酸铜的物质的量为:n(CuSO4)=$\frac{8g}{160g/mol}$=0.05mol,所配制的溶液体积为:$\frac{0.05mol}{0.1mol/L}$=0.5L=500mL,
A.8g硫酸铜溶于500mL水中,所得溶液的体积不是0.5L,所以所得溶液的浓度不是0.1mol/L,故A错误;
B.根据以上计算可知,配制的溶液体积为500mL,故B错误;
C.8g无水硫酸铜的物质的量为0.05mol,配制成0.1mol/L的溶液,配制的溶液总体积为500mL,故C正确;
D.配制的溶液体积为0.5L,不是1L,故D错误;
故选C.
点评 本题考查了配制一定物质的量浓度的溶液方法,题目难度不大,注意掌握配物质的量浓度的概念及计算方法,明确配制一定物质的量浓度的溶液方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.沼气是一种能源,它的主要成分是CH4,0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热最,则下列热化学方程式中正确的是( )
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890kJ•mol-1 | |
| C. | CH4(g)+O2(g)═CO2(g)+H2O(l)△H=-890kJ•mol-1 | |
| D. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(g)△H=+890kJ•mol-1 |
17.以苯为原料,不能通过一步反应制得的有机物是( )
| A. |  | B. |  | C. |  | D. |  |
4.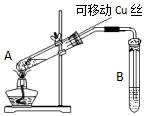 在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )
在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )
 在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )
在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )| A. | 0.25mol•L-1 | B. | 0.5mol•L-1 | C. | 0.025mol•L-1 | D. | 0.05mol•L-1 |
14.下列物质一定属于同系物的是( )
①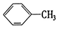 ②
②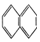 ③
③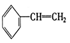 ④C2H4⑤CH2=CH-CH=CH2⑥C3H4⑦
④C2H4⑤CH2=CH-CH=CH2⑥C3H4⑦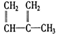 ⑧
⑧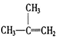
①
 ②
② ③
③ ④C2H4⑤CH2=CH-CH=CH2⑥C3H4⑦
④C2H4⑤CH2=CH-CH=CH2⑥C3H4⑦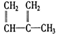 ⑧
⑧
| A. | ④和⑥ | B. | ①、②和③ | C. | ⑤和⑦ | D. | ④、⑥和⑧ |
1.常温下,向一定体积的0.1mol/L的醋酸溶液中加水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目减少 | |
| B. | 醋酸的电离程度增大,c(H+)亦增大 | |
| C. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$不变 | |
| D. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 |
18.下列物质能使酸性高锰酸钾溶液褪色,但不能使溴的CCl4 溶液褪色的是( )
| A. | 乙烯 | B. | 苯 | C. | 甲苯 | D. | 乙酸 |
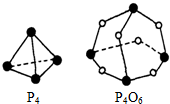 白磷(P4)和P4O6的分子结构如图.现提供以下化学键的键能:P-P为E1kJ•mol-1、P-O为E2kJ•mol-1、O=O为E3 kJ•mol-1.则:P4(s)+3O2(g)═P4O6(s)的反应热△H=kJ•mol-1(6E1+3E3-12E2)kJ•mol-1(用E1,E2,E3表示).
白磷(P4)和P4O6的分子结构如图.现提供以下化学键的键能:P-P为E1kJ•mol-1、P-O为E2kJ•mol-1、O=O为E3 kJ•mol-1.则:P4(s)+3O2(g)═P4O6(s)的反应热△H=kJ•mol-1(6E1+3E3-12E2)kJ•mol-1(用E1,E2,E3表示).