题目内容
20.工业上利用氟碳铈矿(主要成分CeCO3F)提取CeCl3的一种工艺流程如图: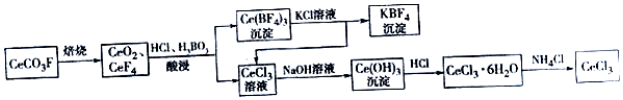
请回答下列问题:
(1)CeCO3F中,Ce元素的化合价为+3.
(2)酸浸过程中可用稀硫酸和H2O2替换HCl,优点为避免产生Cl2,不会造成环境污染;写出稀硫酸、H2O2与CeO2反应的离子方程式:H2O2+2CeO2+6H+=2Ce3++4H2O+O2↑
(3)写出Ce(BF4)3中加入KCl溶液反应的离子方程式:Ce(BF4)3+3K+═3KBF4+Ce3+
(4)化学家研究发现,SbF5转化成稳定离子[SbF6]-的盐反应得到,SbF5转化成稳定离子[SbF6]-的盐.而SbF4很不稳定,受热易分解为SbF3和F2.根据据以上研究写出以K2MnF6和SbF5为原料,在 423K 的温度下制备F2的化学方程式:2K2MnF6+4SbF5$\frac{\underline{\;423K\;}}{\;}$4KSbF6+2MnF3+F2↑.
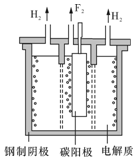
现代工业以电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,电解制氟装置如图所示. 已知KHF2是一种酸式盐,写出阴极上发生的电极反应式2HF2-+2e-═H2↑+4F-.电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是氟气和氢气能发生剧烈反应,引发爆炸.
(5)已知25℃时,HF的电离平衡常数Ka=3.6×10-4,CaF2的溶解积常数Ksp(CaF2)=1.46×10-10.现向1L 0.2mol/L HF溶液中加入 1L 0.2mol/L CaCl2 溶液,通过列式计算说明是否有沉淀产生:c(H+)=c(F-)=$\sqrt{3.6×10-4×0.1}$mol•L-1=6×10-3mol•L-1,c(Ca2+)=0.1mol•L-1,c2(F-)•c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10,该体系有CaF2沉淀.
分析 由氟碳铈矿(主要成分CeCO3F)提取CeCl3的工艺流程,CeCO3F焙烧得CeO2、CeF4,用盐酸和硼酸酸浸,过滤得沉淀Ce(BF)4和CeCl3滤液,Ce(BF)4与氯化钾溶液反应得到CeCl3和KBF4,CeCl3与前面滤液中CeCl3的合并再加氢氧化钠,得Ce(OH)3沉淀,Ce(OH)3沉淀与盐酸反应可得CeCl3•6H2O,加热CeCl3•6H2O和NH4Cl的固体混合物可得到无水CeCl3,
(1)根据化合价代数和为0判断;
(2)用稀硫酸和H2O2替换HCl不会造成环境污染;在酸性条件下H2O2能还原CeO2生成Ce3+,根据元素守恒和电荷守恒书写离子方程式;
(3)Ce(BF4)3中加入KCl溶液反应生成CeCl3和KBF4;
(4)根据题意K2MnF6和SbF5在 423K 的温度下反应KSbF6、MnF3、F2;阴极发生还原反应,由图可知阴极生成氢气;氟气和氢气能发生剧烈反应,引发爆炸;
(5)c(H+)=c(F-)=$\sqrt{3.6×10-4×0.1}$mol•L-1=6×10-3mol•L-1,c(Ca2+)=0.1mol•L-1,计算c2(F-)•c(Ca2+),与Ksp(CaF2)比较可得.
解答 解:(1)根据化合价代数和为0可知,CeCO3F中,Ce元素的化合价为+3价,
故答案为:+3;
(2)酸浸过程中可用稀硫酸和H2O2替换HCl,避免产生Cl2,不会造成环境污染;稀硫酸、H2O2与CeO2反应的离子方程式为:H2O2+2CeO2+6H+=2Ce3++4H2O+O2↑;
故答案为:避免产生Cl2,不会造成环境污染;H2O2+2CeO2+6H+=2Ce3++4H2O+O2↑;
(3)Ce(BF4)3中加入KCl溶液反应生成CeCl3和KBF4,离子反应为:Ce(BF4)3+3K+═3KBF4+Ce3+;
故答案为:Ce(BF4)3+3K+═3KBF4+Ce3+;
(4)根据题意K2MnF6和SbF5在 423K 的温度下反应KSbF6、MnF3、F2,反应为:2K2MnF6+4SbF5$\frac{\underline{\;423K\;}}{\;}$4KSbF6+2MnF3+F2↑;电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,由图可知,阴极生成氢气发生还原反应,电极反应式为:2HF2-+2e-═H2↑+4F-;氟气和氢气能发生剧烈反应,引发爆炸,故要用镍铜合金隔板将两种气体产物严格分开;
故答案为:2K2MnF6+4SbF5$\frac{\underline{\;423K\;}}{\;}$4KSbF6+2MnF3+F2↑;2HF2-+2e-═H2↑+4F-;氟气和氢气能发生剧烈反应,引发爆炸;
(5)HF的电离平衡常数Ka=3.6×10-4,c(H+)=c(F-)=$\sqrt{3.6×10-4×0.1}$mol•L-1=6×10-3mol•L-1,c(Ca2+)=0.1mol•L-1,c2(F-)•c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10,该体系有CaF2沉淀;
故答案为:c(H+)=c(F-)=$\sqrt{3.6×10-4×0.1}$mol•L-1=6×10-3mol•L-1,c(Ca2+)=0.1mol•L-1,c2(F-)•c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10,该体系有CaF2沉淀.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、电解原理、溶度积的计算等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. |  | B. |  | C. |  | D. |  |
| A. | 1735Cl与1737Cl得电子能力相同 | |
| B. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| C. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 | |
| D. | 砹(At)为有色固体,HAt不稳定 |
| A. | 氢氧燃料电池 | B. | 锌锰电池 | C. | 镍镉电池 | D. | 锂电池 |
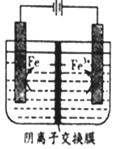
| A. | .阳极主要发生反应:Fe2+-e-═Fe3+ | |
| B. | 可用高纯铁电极作阴扱 | |
| C. | .电解液中的SO42-由右向左通过阴离子交换膜 | |
| D. | .电解法制备髙纯铁总反应:3Fe2+$\frac{\underline{\;通电\;}}{\;}$Fe+2Fe3+ |
| 实验操作和现象 | 实验结论 | |
| A | 分别向2mL 0.1mol•L-1 CH3COOH溶液和2mL 0.1mol•L-1H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性:CH3COOH>H2CO3>H3BO3 |
| B | 用3mL稀盐酸与过量Zn反应,当气泡稀少时,加入1mL 浓盐酸,又迅速产生较多气泡 | 盐酸浓度增大,反应速率加快 |
| C | 向少量无水乙醇中加入一小粒金属Na,生成可燃性气体 | CH3CH2OH是弱电解质 |
| D | 向2mL 0.1mol•L-1 NaOH溶液中滴加3滴0.1mol•L-1 MgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol•L-1 FeCl3溶液,出现红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| A. | A | B. | B | C. | C | D. | D |
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为2:1;
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:

①电解时发生反应的化学方程式为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑;
②设计实验来确定溶液X的成份,请补充完成实验步骤和现象
| 实验步骤 | 实验现象 | 实验结论 |
| I:取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 | 溶液X中含有钠离子 | |
| II:取少许溶液X于一支试管中,滴加先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液), | 溶液X中含有氯离子 |
a.水b.碱石灰c.浓硫酸d.饱和食盐水
(3)O2处理过的饮用水会含有一定量的亚氯酸盐.若要除去超标的亚氯酸盐,下列物质最适宜的是d填标号).
a.明矾 b.碘化钾 c.盐酸d.硫酸亚铁.
 二氧化硫是大气的主要污染物之利用电化学原理可将SO2转化为主要化工原料-H2SO4,其工作原理如图所示下列说法正确的是( )
二氧化硫是大气的主要污染物之利用电化学原理可将SO2转化为主要化工原料-H2SO4,其工作原理如图所示下列说法正确的是( )| A. | 乙电极为正极,发生氧化反应 | |
| B. | H+从正极区通过交换膜移向负极区 | |
| C. | 甲电极的反应式为:SO2-2e-+2H2O═SO42-+4H+ | |
| D. | 乙电极上每消耗5.6LO2时,电路中通过1mol电子 |
 .
.