题目内容
8.根据原子结构及元素周期律的知识,下列推断错误的是( )| A. | 1735Cl与1737Cl得电子能力相同 | |
| B. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| C. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 | |
| D. | 砹(At)为有色固体,HAt不稳定 |
分析 A.得失电子能力取决于核外电子排布,二者核外电子排布完全相同,则得失电子能力相同;
B.Sr与Ca同主族,化合物性质相似;
C.S、Se同主族,非金属性S>Se;
D.砹为ⅤⅡA族元素,从上到下,单质的颜色加深,由气到固,非金属性减弱.
解答 解:A.1735Cl与1737Cl都是Cl原子,两个原子的核外电子排布相同,则得失电子能力相同,故A正确;
B.Sr与Ca同主族,化合物性质相似,碳酸钙为难溶物,则SrSO4是难溶于水的白色固体,故B正确;
C.S、Se同主族,非金属性S>Se,则H2Se不如H2S稳定,故C错误;
D.砹为ⅤⅡA族元素,从上到下,单质的颜色加深,由气到固,则砹(At)为有色固体,从上到下非金属性减弱,则HAt不稳定,故D正确;
故选C.
点评 本题考查元素周期表和元素周期律的综合应用,为高频考点,涉及得失电子能力强弱、金属性和非金属性比较等知识,把握元素的位置、元素周期律即可解答,题目难度不大.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
3.下列分子中,σ键和π键数目之比为3:1的是( )
| A. | CO2 | B. | C2H4 | C. | HCN | D. | HCHO |
13.某同学用如图装置及药品进行酸性强弱的实验,下列说法不正确的是( )


| A. | ①和②中发生的反应均为复分解反应 | |
| B. | 若将实验中的稀硫酸换成稀盐酸也能比较三种酸强弱 | |
| C. | 一段时间后②中有胶冻状物质生成 | |
| D. | 该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸 |
18.短周期元素X、Y、Z、W、R的原子序数依次增大,其中只有Z和W是金属元素,X与Z同一主族;Y的气态氢化物与其最高价氧化物对应水化物可以化合生成盐;W的氢氧化物可与Z 和R的最高价氧化物对应水化物反应;R的单质常温下是黄绿色气体,常用于自来水的杀菌、消毒.下列说法正确的是( )
| A. | 原子半径:Y<Z<W | |
| B. | X元素的最高正价和最低负价的绝对值相等 | |
| C. | Y的单质化学性质很稳定,不与任何金属发生反应 | |
| D. | 工业上通常用W和R形成的化合物来冶炼金属W |


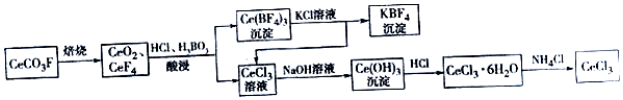
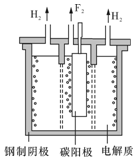

 .
.