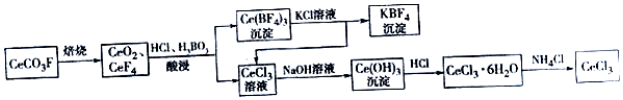
��Ŀ����
11��A��B��C��D��Ϊ������Ԫ�أ�A��B���γ�����Һ̬��������ң������ʽ�ֱ�ΪBA��B2A��A��D���γ���̬������DA��DA2��B��D���γ�һ�ּ�������ˮ�ļ�������X��B��C���γɼ�������ˮ����������Y��Y����ˮ����ȫ���룮��֪X�������ҷ����еĵ�������ȣ�Y����������еĵ�������ȣ���ش���1���ĵ���ʽΪ
 ��
����2�������£�aL pHΪ2��Y��Һ��bL pHΪ12������������Һ��Ϻ�������ҺpH=3����a��b=11��9��
��3��X����ˮ�������룬д�����뷽��ʽNH3•H2O?NH4++NH2-����֪X��Һ̬ʱ��ˮһ�����ɷ������ĵ��룬�������ֺ���ͬ�����������ӣ���д�����ĵ��뷽��ʽ��2NH3?NH4++NH2-��
��4��X�����һ�������¿ɷ�����Ӧ����������Ⱦ�IJ��д����Ӧ�Ļ�ѧ����ʽ2NH3+3H2O2$\frac{\underline{\;һ������\;}}{\;}$N2+6H2O��
���� A��B��C��D��Ϊ������Ԫ�أ�A��B���γ�����Һ̬��������ң������ʽ�ֱ�ΪBA��B2A����ס��ҷֱ�ΪH2O2��H2O����AΪO��BΪHԪ�أ���B��D���γ�һ�ּ�������ˮ�ļ�������X����ѧ�μ�������ֻ��NH3����DΪNԪ�أ�A��O����D��N�����γ���̬������NO��NO2������������B��C���γɼ�������ˮ����������Y��Y����ˮ����ȫ���룬��YΪHCl��CΪClԪ�أ�ͨ����֤NH3������H2O�����еĵ�������ȣ�HCl������H2O2�����еĵ�������ȣ��ݴ˾ݴ˽��н��
��� �⣺A��B��C��D��Ϊ������Ԫ�أ�A��B���γ�����Һ̬��������ң������ʽ�ֱ�ΪBA��B2A����ס��ҷֱ�ΪH2O2��H2O����AΪO��BΪHԪ�أ���B��D���γ�һ�ּ�������ˮ�ļ�������X����ѧ�μ�������ֻ��NH3����DΪNԪ�أ�A��O����D��N�����γ���̬������NO��NO2������������B��C���γɼ�������ˮ����������Y��Y����ˮ����ȫ���룬��YΪHCl��CΪClԪ�أ�ͨ����֤NH3������H2O�����еĵ�������ȣ�HCl������H2O2�����еĵ�������ȣ�
��1����ΪH2O2�����ڹ��ۻ���������ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��2�������£�aL pH=2��Y��HCl����Һ��bL pH=12������������Һ��Ϻ�������ҺpH=3����$\frac{0.01mol/L��aL-0.01mol/L��bL}{aL+bL}$=0.001mol/L�������ɵ�a��b=11��9��
�ʴ�Ϊ��11��9��
��3��XΪNH3����������ˮ�γ�NH3•H2O��NH3•H2OΪ�������Һ�в��ֵ��룬����뷽��ʽΪ��NH3•H2O?NH4++OH-��
Һ̬NH3����H2O��Ҳ���������Ҳ�����������ͬ���������ӣ����������������ΪNH4+��NH2-������뷽��ʽΪ2NH3?NH4++NH2-��
�ʴ�Ϊ��NH3•H2O?NH4++OH-��2NH3?NH4++NH2-��
��4��XΪ��������Ϊ˫��ˮ����һ�������¶��߿ɷ�����Ӧ��������Ⱦ�IJ������Ӧ��Ϊ������ˮ����Ӧ����ʽΪ��2NH3+3H2O2$\frac{\underline{\;һ������\;}}{\;}$N2+6H2O��
�ʴ�Ϊ��2NH3+3H2O2$\frac{\underline{\;һ������\;}}{\;}$N2+6H2O��
���� ���⿼��λ�ýṹ������֮��Ĺ�ϵ����Ŀ�Ѷ��еȣ��ƶ�Ԫ��Ϊ���ؼ���ע������ԭ�ӽṹ��Ԫ�������ɡ�Ԫ�����ڱ��Ĺ�ϵ���������������ѧ���ķ������������Ӧ��������

 �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д� ��������ϵ�д�
��������ϵ�д�| A�� | C3H8�����е�̼ԭ��һ������ͬһֱ���� | |
| B�� | �������Ҵ���Ӧ�Ļ�ѧ����ʽ��CH3COOH+C2H518OH$?_{��}^{ŨH_{2}SO_{4}}$CH3CO18OC2H5+H2O | |
| C�� | ����ˮ��������ֲ���ͺͿ����ͣ�Ҳ��������CCl4�ͱ� | |
| D�� | ����ʽΪC5H12O���л�����Cu�Ĵ������·����������������ﲻ�ܷ���������Ӧ���У������������칹��3 �� |
| ������Ԥ������ | ���� | |
| A | ��25mL��ˮ�ͷ�ˮ�зֱ����5��FeCl3������Һ��ǰ��Ϊ��ɫ������Ϊ���ɫ | �¶����ߣ�Fe3+��ˮ��̶����� |
| B | ��ij��ɫ��Һ�μ������ữ��BaCl2��Һ��������ɫ���� | ԭ��Һ��һ������SO42- |
| C | A1������ϡHNO3�У������� | A1�����汻HNO3�������γ����ܵ�����Ĥ |
| D | �ýྻ��˿պȡ��Һ������ɫ��Ӧ������ʻ�ɫ | ԭ��Һ����Na+��K+ |
| A�� | A | B�� | B | C�� | C | D�� | D |
| A�� | ������ˮ | B�� | ����Ȼ������Ҫ�ɷ� | ||
| C�� | �����������ӳɷ�Ӧ | D�� | �����黥Ϊͬ���칹�� |
| A�� | CO2 | B�� | C2H4 | C�� | HCN | D�� | HCHO |
| A�� | �ⶨ�кͷ�Ӧ��Ӧ��ʵ���У�Ϊ�˳�ַ�Ӧ��Ӧ��NaOH��Һ�������������� | |
| B�� | ����FeCl3��Һʱ����FeCl3�������ܽ��ڽ�Ũ�������У��ټ�����ˮϡ�͵�����Ũ�� | |
| C�� | ������ζ�NaOH��Һʱ�����ֿ�����ʽ�ζ��ܻ�������������ƿ���۾�ע�ӵζ�����Һ�� | |
| D�� | ����Fe��NOs��2�����Ƿ����ʱ����Fe��NO3��2��Ʒ����ϡH2SO4���ٵμ�KSCN��Һ |