题目内容
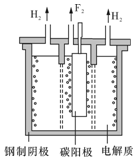
5.用惰性电极电解FeSO4溶液制备高纯铁的原理如图所示.下列说法错误的是( )
| A. | .阳极主要发生反应:Fe2+-e-═Fe3+ | |
| B. | 可用高纯铁电极作阴扱 | |
| C. | .电解液中的SO42-由右向左通过阴离子交换膜 | |
| D. | .电解法制备髙纯铁总反应:3Fe2+$\frac{\underline{\;通电\;}}{\;}$Fe+2Fe3+ |
分析 A.阳极上失电子发生氧化反应;
B.连接电源负极的为阴极,阴极材料没有特殊要求;
C.阴离子移向阳极;
D.阴极上发生Fe2++2e-═Fe,阳极上发生2Fe2+-2e-═2Fe3+,据此确定总的电极反应方程式.
解答 解:A.阳极上失电子发生氧化反应,主要发生反应为2Fe2+-2e-═2Fe3+,故A正确;
B.B.连接电源负极的为阴极,阴极材料没有特殊要求,故可用高纯铁电极作阴极,故B正确;
C.阴离子移向阳极,且连接电源正极的为阳极,故电解液中的SO42-由左向右通过阴离子交换膜,故C错误;
D.阴极上发生Fe2++2e-═Fe,阳极上发生2Fe2+-2e-═2Fe3+,总电解反应为3Fe2+$\frac{\underline{\;通电\;}}{\;}$Fe+2Fe3+,故D正确;
故选C.
点评 本题考查电解原理及应用,为高频考点,把握惰性电极及发生的电解反应为解答的关键,侧重分析与应用能力的考查,注意选项C离子移动问题,题目难度不大.

练习册系列答案
相关题目
4.分子式为C5H9Br的有机物,其结构可能是( )
| A. | 只含有2个双键的直链有机物 | B. | 含1个双键的直链有机物 | ||
| C. | 含1个双键的环状有机物 | D. | 含一个三键的直链有机物 |
13.某同学用如图装置及药品进行酸性强弱的实验,下列说法不正确的是( )


| A. | ①和②中发生的反应均为复分解反应 | |
| B. | 若将实验中的稀硫酸换成稀盐酸也能比较三种酸强弱 | |
| C. | 一段时间后②中有胶冻状物质生成 | |
| D. | 该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸 |
15.我国科学家成功研制出一种全新的铝-石墨双离子电池(AGDIB).这种新型AGDIB电池采用廉价且易得的石墨作为电池正极材料,铝锂(AlLi)合金作为负极材料,LiPF6是电解质,碳酸酯为溶剂,反应原理是 AlLi+Cx(PF6)$?_{充电}^{放电}$LiPF6+xC+Al.下列关于该电池的说法不正确的是( )
| A. | 该电池不能用水溶液作为电解质 | |
| B. | 放电时,Li+在电解质中由负极向正极迁移 | |
| C. | 充电时,若转移1 mol e-,阴极电极将增重7g | |
| D. | 放电时,正极的电极反应式为AlLi-e-═Li++Al |


 .
.


