题目内容
9.硝酸生产中,500℃时,NH3和O2可能发生如下反应:①4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g);△H=-907.2kJ•mol-1 K=1.1×1026
②4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g);△H=-1104.9kJ•mol-1 K=4.4×1028
③4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g);△H=-1269.2kJ•mol-1K=7.1×1034
下列说法正确的是( )
| A. | 增大压强,则反应的②K不变,反应①和③的K减小 | |
| B. | 500℃时,2NH3(g)+2O2 (g)?N2O (g)+3H2O (g) K=2.2×1028 | |
| C. | 500℃时,N2 (g)+O2 (g)=2NO (g)△H=+181 kJ•mol-1 | |
| D. | 500℃时,2 mol NH3 与2.5 mol O2混合发生反应①,可放出热量453.6 kJ |
分析 A.K是温度的函数;
B.平衡常数与化学计量数有关;
C.由盖斯定律可知反应N2 (g)+O2 (g)=2NO(g)△H=$-\frac{③}{2}+\frac{①}{2}$;
D.4NH3 (g)+5O2(g)?4NO (g)+6H2O (g)是可逆反应,不能完全进行.
解答 解:A.增大压强,则反应的②K不变,反应①和③的K不变,故A错误;
B.由反应②4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g)△H=-1104.9kJ•mol-1K=4.4×1028,可知500℃时,2NH3 (g)+2O2 (g)?N2O (g)+3H2O (g) K=$\sqrt{4.4×1{0}^{28}}$,故B错误;
C.反应N2 (g)+O2 (g)=2NO(g)△H=$-\frac{③}{2}+\frac{①}{2}$=$\frac{1269.2-907.2}{2}$=+181 kJ•mol-1,故C正确;
D.4NH3 (g)+5O2(g)?4NO (g)+6H2O (g)是可逆反应,不可能完全转化,所以放出热量小于453.6 kJ,故D错误;
故选C.
点评 本题考查了化学平衡常数的影响因素和盖斯定律书写热化学方程式,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意盖斯定律的应用.

练习册系列答案
相关题目
6.如图的烧杯中盛的都是海水,铁在其中被腐蚀的速率由快到慢的顺序为( )


| A. | ③④②① | B. | ③④①② | C. | ④②①③ | D. | ②①③④ |
7.下列说法正确的是( )
| A. | 氧化还原反应中氧化剂和还原剂一定是两种物质 | |
| B. | 氧化还原反应中氧化产物和还原产物一定是两种物质 | |
| C. | 作氧化剂的物质一定不能作还原剂 | |
| D. | 所含元素处于中间价态时的物质,既可作氧化剂也可作还原剂 |
17.下列说法中正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应,吸热反应的生成物总能量一定高于反应物总能量 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g) 在光照和点燃条件下的△H不同 | |
| C. | 一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| D. | 一定条件下4 HCl(g)+O2(g)═2Cl2(g)+2H2O(g),当1 mol O2反应放出115.6 kJ热量,键能如下所示,则断裂1 mol H-O键与断裂1 mol H-Cl键所需能量差为31.9 kJ Cl2(g)$\stackrel{243kJ/mol}{→}$2Cl(g) O2(g)$\stackrel{498kJ/mol}{→}$2O(g) |
1.下列仪器用于过滤和蒸发分离物质的是( )
①漏斗 ②试管 ③蒸发皿 ④天平 ⑤烧杯 ⑥研钵.
①漏斗 ②试管 ③蒸发皿 ④天平 ⑤烧杯 ⑥研钵.
| A. | ①③④ | B. | ①②⑥ | C. | ①③⑤ | D. | ①③⑥ |
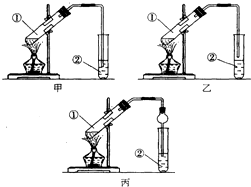 下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.
下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.
 CH3COOCH2CH3+H2O;反应类型酯化反应.
CH3COOCH2CH3+H2O;反应类型酯化反应.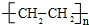 ;反应类型加聚反应.
;反应类型加聚反应.