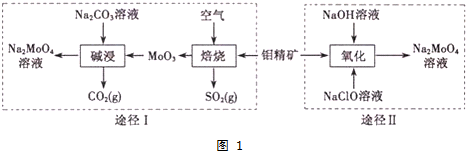
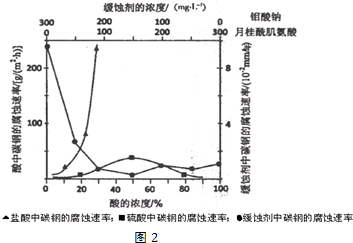
题目内容
17.下列说法中正确的是( )| A. | 需要加热才能发生的反应一定是吸热反应,吸热反应的生成物总能量一定高于反应物总能量 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g) 在光照和点燃条件下的△H不同 | |
| C. | 一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| D. | 一定条件下4 HCl(g)+O2(g)═2Cl2(g)+2H2O(g),当1 mol O2反应放出115.6 kJ热量,键能如下所示,则断裂1 mol H-O键与断裂1 mol H-Cl键所需能量差为31.9 kJ Cl2(g)$\stackrel{243kJ/mol}{→}$2Cl(g) O2(g)$\stackrel{498kJ/mol}{→}$2O(g) |
分析 A.反应热与是否加热才能进行无关;
B.反应热与反应的条件无关;
C.为可逆反应,不能完全进行;
D.断裂化学键吸收能量,形成化学键放出能量,结合化学键的键能计算.
解答 解:A.是否加热为引发反应的外界条件,反应热与是否加热才能进行无关,故A错误;
B.反应热与反应的条件无关,同温同压下,H2(g)+Cl2(g)═2HCl(g) 在光照和点燃条件下的△H相同,故B错误;
C.为可逆反应,不能完全进行,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3kJ,如完全反应放出的热量大于19.3kJ,则C错误;
D.断裂化学键吸收能量,形成化学键放出能量,设断裂1 mol H-O键与断裂1 mol H-Cl键所需能量分别为x、y,则(4y+498)-(2×243+4×x)=-115.6,则x-y=31.9,故D正确.
故选D.
点评 本题考查反应热与焓变,为高频考点,侧重于学生的分析能力和计算能力的考查,本题注意可逆反应的特点以及反应热与化学键键能的关系,难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
14.有关水在人体中的作用,下列说法不正确的是( )
| A. | 水是一种很好的溶剂 | B. | 水在人体内还有调节体温的作用 | ||
| C. | 饮用水越纯净对身体越好 | D. | 水是反应介质和反应物 |
15.下列各组中的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | Cu(OH)2+HC1; Cu(OH)2+CH3COOH | B. | NaHCO3+H2SO4;Na2CO3+HCl | ||
| C. | NaHS04+NaOH; H2SO4+NaOH | D. | BaCl2与 Na2SO4;Ba(OH)2 与 CuSO4 |
9.硝酸生产中,500℃时,NH3和O2可能发生如下反应:
①4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g);△H=-907.2kJ•mol-1 K=1.1×1026
②4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g);△H=-1104.9kJ•mol-1 K=4.4×1028
③4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g);△H=-1269.2kJ•mol-1K=7.1×1034
下列说法正确的是( )
①4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g);△H=-907.2kJ•mol-1 K=1.1×1026
②4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g);△H=-1104.9kJ•mol-1 K=4.4×1028
③4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g);△H=-1269.2kJ•mol-1K=7.1×1034
下列说法正确的是( )
| A. | 增大压强,则反应的②K不变,反应①和③的K减小 | |
| B. | 500℃时,2NH3(g)+2O2 (g)?N2O (g)+3H2O (g) K=2.2×1028 | |
| C. | 500℃时,N2 (g)+O2 (g)=2NO (g)△H=+181 kJ•mol-1 | |
| D. | 500℃时,2 mol NH3 与2.5 mol O2混合发生反应①,可放出热量453.6 kJ |
7.在下列各说法中,正确的是( )
| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 0.5 mol H2SO4与0.5 mol Ba(OH)2完全反应生成BaSO4时放出的热叫做中和热 | |
| C. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 | |
| D. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 |
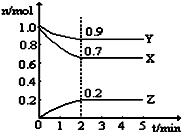 (1)反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L•min)、②vC=0.5mol/(L•min)、③vB=0.5mol/(L•min),三种情况下该反应速率由大到小的关系是③>①>②.(用序号表示)
(1)反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L•min)、②vC=0.5mol/(L•min)、③vB=0.5mol/(L•min),三种情况下该反应速率由大到小的关系是③>①>②.(用序号表示)