题目内容
20.某工厂废弃的钒渣中主要含V2O5、VOSO4、K2SO4、SiO2等,现从该钒渣回收V2O5的工艺流程示意图如下: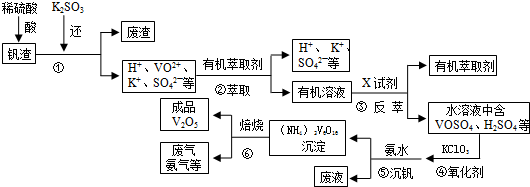
回答下列问题:
(1)(NH4)2V6O16中钒(V)的化合价为+5,①中废渣的主要成分是SiO2.
(2)工艺中反萃取所用的X试剂为稀硫酸.
(3)②、③的变化过程可简化为(其中R表示VO2+,HA表示有机萃取剂):R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层),为提高②中萃取效率,应采取的措施是加入碱(具体碱均可)中和硫酸使平衡正移、多次连续萃取.
(4)请完成④中的反应离子方程式:1ClO3-+6VO2++6H+=6VO3++1Cl-+3H2O.
(5)成品V2O5可通过铝热反应来制取金属钒,写出该反应的化学方程式:10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
(6)将两个全钒液流储能电池串联后作为电源,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,装置如图:
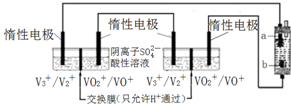
b为电解池的阳极,全钒液流储能电池正极的电极反应式为VO2++e-+2H+=VO2++H2O.
分析 钒渣中主要含V2O5、VOSO4、K2SO4、SiO2等,加硫酸,二氧化硅不溶解,加入还原剂K2SO3,V2O5被还原为VO2+离子,加入有机萃取剂,通过萃取②,把剩余的酸和有机层分开,通过反萃取③,把萃取剂和离子分开,加入氧化剂氯酸钾④,氯酸钾把VO2+氧化成VO3+,离子方程式为:ClO3-+6VO2++6H+→6VO3++Cl-+3H2O,调节pH得到含钒的沉淀,焙烧得到V2O5和氨气,有机萃取剂和氨气再循环利用.
(1)根据化合价代数和为0确定化合价;废钒催化剂的主要成分中二氧化硅不溶于酸;
(2)③中反萃取时加入的X试剂是抑制平衡正向进行;
(3)②中萃取时必须加入适量碱,分析平衡,R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层),加入的碱会和平衡中的氢离子反应促进平衡正向进行;提高②中萃取效率还可多次连续萃取;
(4)用化合价升降法配平方程式;
(5)铝热反应实质是置换反应,铝与五氧化二钒反应生成钒与氧化铝;
(6)在电解池的阴极上是阳离子得电子发生还原反应,在阳极上是阴离子发生失电子的氧化反应;原电池的正极发生还原反应.
解答 解:钒渣中主要含V2O5、VOSO4、K2SO4、SiO2等,加硫酸,二氧化硅不溶解,加入还原剂K2SO3,V2O5被还原为VO2+离子,加入有机萃取剂,通过萃取②,把剩余的酸和有机层分开,通过反萃取③,把萃取剂和离子分开,加入氧化剂氯酸钾④,氯酸钾把VO2+氧化成VO3+,离子方程式为:ClO3-+6VO2++6H+→6VO3++Cl-+3H2O,调节pH得到含钒的沉淀,焙烧得到V2O5和氨气,有机萃取剂和氨气再循环利用.
(1)氮的化合价为-3价,氢得化合价为+1价,氧的化合价为-2价,设(NH4)2V6O16中钒中V元素的化合价为x,根据化合价代数和为0得:[-3+1×(+4)]×2+6x+(-2)×16=0,解得x=+5,二氧化硅不和硫酸反应,故废渣中含二氧化硅,
故答案为:+5;SiO2;
(2)③中反萃取时加入的X试剂是抑制平衡正向进行,可以加入硫酸抑制平衡正向进行,故答案为:稀硫酸;
(3))②中萃取时必须加入适量碱,分析平衡,R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层),即Rn+(水层)+nHA(有机层)?RAn(有机层)+nH+(水层),加入碱(具体碱均可)中和硫酸使平衡正移,提高②中萃取效率还可采取多次连续萃取,
故答案为:加入碱(具体碱均可)中和硫酸使平衡正移、多次连续萃取;
(4)氯元素化合价从+5→-1,化合价降低6,钒化合价从+4→+5,化合价升高1,二者最小公倍数为6,把变价元素配平,初步配平为:ClO3-+6VO2++H+→6VO3++Cl-+H2O,根据氧原子守恒确定H2O前系数为3,氢离子前系数为6,故配平后为:ClO3-+6VO2++6H+=6VO3++Cl-+3H2O,
故答案为:1;6;6;6;1Cl-;3H2O;
(5)铝与五氧化二钒反应生成钒与氧化铝,反应反应方程式为:10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3,故答案为:10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3;
(6)将两个全钒液流储能电池串联后作为电源,用石墨作电极电解饱和氯化钠溶液,若通电时,为使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电解池的下端产生的是氯气,上端产生的是氢气,电解池的阴极上是阳离子氢离子得电子发生得电子的还原反应,生成氢气,在阳极上是阴离子氯离子发生失电子的氧化反应,生成氯气,所以a是阴极,b是阳极生成Cl2,原电池的正极得到电子发生还原反应,全钒液流储能电池正极的电极反应式为:VO2++e-+2H+=VO2++H2O,
故答案为:阳;VO2++e-+2H+=VO2++H2O.
点评 本题考查了流程分析判断,为高考常见题型,侧重考查物质性质和实验设计的方法应用、题干信息分析判断能力,注意把握物质的分离提纯、电解反应、电极产物的分析应用、工艺流程的理解,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
| A. | 1mol该有机物在加热和催化剂作用下,最多能和4molH2反应 | |
| B. | 该有机物分子式为C11H13Cl | |
| C. | 该有机物遇硝酸银溶液产生白色沉淀 | |
| D. | 该有机物在一定条件下,能发生消去反应或取代反应 |
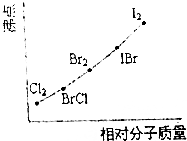 (1)在已知存在H2、Cl2、I2、HCl和Hl的时代,根据原子通过共价键形成分子的基本特点(如下图),推测还可能存在的一种化合物(A),其化学式为ICl.
(1)在已知存在H2、Cl2、I2、HCl和Hl的时代,根据原子通过共价键形成分子的基本特点(如下图),推测还可能存在的一种化合物(A),其化学式为ICl. | H- | Cl- | I- | |
| -H | H-H | H-Cl | H-I |
| -Cl | H-Cl | Cl-Cl | |
| -I | H-I | I-I |
| 反应物 | 化合物(A) | Br2 |
| Na | 2Na+Br2=2NaBr | |
| H2 | H2+Br2=2HBr | |
| H2O | H2O+Br2?HBr+HBrO | |
| Kl | 2Kl+Br2=I2+2KBr |
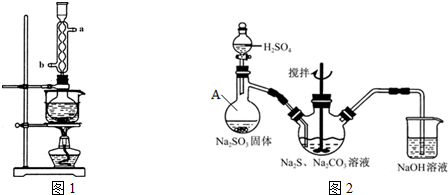
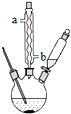 苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:
苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
| 苯甲酸钠 | 144 | - | 249.3 | 易溶于水 |
(1)制备苯甲酸
在三颈瓶中加入4mL甲苯和20mL稀硫酸,放入碎瓷片后,加热至沸腾,加入12.8g高锰酸钾,加热到甲苯层消失.将三颈瓶在冰水浴中冷却,分离出苯甲酸.
①球形冷凝管的作用是冷凝回流,其进水口是b(填“a”或“b”).
②三颈瓶中反应的离子方程式
 .
.③分离苯甲酸选用的玻璃仪器是BCD(填标号)
A分液漏斗 B玻璃棒 C烧杯 D漏斗 E蒸馏烧瓶 F直形冷凝管
④分离出的苯甲酸晶体中可能含有的杂质是K2SO4、MnSO4,为进一步提纯,应采用的方法是重结晶.
(2)制备苯甲酸钠
控制温度为70℃,向三颈瓶中加入61.0g苯甲酸和适量的32%的碳酸钠溶液,充分反应后停止加热.在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体.
⑤控制温度为70℃的方法是水浴加热.
⑥加入活性炭的作用是吸附色素.
⑦若提纯得到46.8g苯甲酸钠.则苯甲酸钠的产率是65.0%.
| A. | 天津港爆炸残留的剧毒物 NaCN,利用双氧水将其氧化为 NaHCO3 和 NH3降低毒性 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5 微粒均具有丁达尔效应 | |
| C. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| D. | 氢氧化钠可作胃酸的中和剂 |