题目内容
5.25℃时,50mL0.10mol/L的醋酸中存在平衡:CH3COOH?CH3COO-+H+.若分别作如下改变,对上述平衡有何影响?(1)加入少量0.10mol/L盐酸,平衡将向向左移动(填“向右移动”、“向左移动”或“不移动”),溶液中C(H+)将增大(填“增大”、“减小”或“不变”).
(2)加入少量冰醋酸,平衡将向向右移动(填“向右移动”、“向左移动”或“不移动”),醋酸的电离程度将减小(填“增大”、“减小”或“不变”).
分析 (1)加入少量稀盐酸,溶液中氢离子浓度增大,抑制醋酸电离;
(2)加入冰醋酸,醋酸浓度增大平衡向正反应方向移动.
解答 解:(1)加入少量稀盐酸,HCl完全电离、醋酸部分电离,所以溶液中氢离子浓度增大,抑制醋酸电离,平衡向左反应方向移动,
故答案为:向左移动;增大;
(2)加入冰醋酸,醋酸浓度增大平衡向右移动,溶液中C(H+)增大,但是醋酸的电离程度减小,
故答案为:向右移动;减小.
点评 本题考查弱电解质的电离,明确改变条件对哪种离子浓度影响来分析平衡移动方向,题目难度不大,侧重于考查学生的分析能力.

练习册系列答案
相关题目
8.下列说法不正确的是( )
| A. | 光照下2,2-二甲基丙烷与Br2反应其二溴取代物有两种 | |
| B. | 1mol C4HmO完全燃烧,最多消耗O2为6mol | |
| C. | FeCl3溶液可以把5种无色溶液:乙醇、苯酚、AgNO3溶液、KOH溶液、氢硫酸一一区分 | |
| D. | 分子式CF2Cl2、C3H6、C2H4、C2H2均只对应一种化合物 |
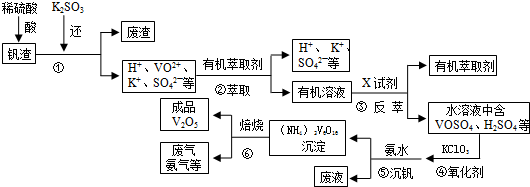
13. 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.
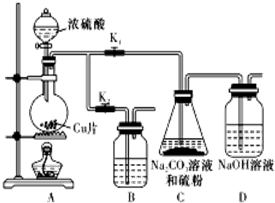
(1)某研究小组设计了制备Na2S2O3•5H2O的装置和部分操作步骤如下.
Ⅰ.打开Kl,并闭K2,向圆底烧瓶中加人足量浓硫酸,加热.
Ⅱ.C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时即停止C中的反应.
Ⅲ.过滤C中的混合液.
Ⅳ.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
①I中,圆底烧瓶中发生反应的化学方程式是:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②Ⅱ中“停止C中的反应”的操作是打开K2,关闭K1.
③Ⅳ中将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.Na2S2O3•5H2O的溶解度随温度升高显著增大,所得产品通过重结晶方法提纯.
④装置B的作用是在C中的反应停止后吸收A中产生的多余SO2防止空气污染.
(2)依据反应2S2O32-+I2═S4O62-+2I-,可用I2的标准溶液测定产品的纯度.取5.5g产品,配制成100mL溶液.取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol•L-1I2的标准溶液进行滴定,相关数据记录如下表所示.
①判断达到滴定终点的现象是加入最后一滴I2标准溶液后,溶液变蓝,且半分钟内颜色不改变.
②Na2S2O3•5H2O在产品中的质量分数是90.2%(Na2S2O3•5H2O的式量为248,计算结果保留1位小数).
 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.(1)某研究小组设计了制备Na2S2O3•5H2O的装置和部分操作步骤如下.
Ⅰ.打开Kl,并闭K2,向圆底烧瓶中加人足量浓硫酸,加热.
Ⅱ.C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时即停止C中的反应.
Ⅲ.过滤C中的混合液.
Ⅳ.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
①I中,圆底烧瓶中发生反应的化学方程式是:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②Ⅱ中“停止C中的反应”的操作是打开K2,关闭K1.
③Ⅳ中将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.Na2S2O3•5H2O的溶解度随温度升高显著增大,所得产品通过重结晶方法提纯.
④装置B的作用是在C中的反应停止后吸收A中产生的多余SO2防止空气污染.
(2)依据反应2S2O32-+I2═S4O62-+2I-,可用I2的标准溶液测定产品的纯度.取5.5g产品,配制成100mL溶液.取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol•L-1I2的标准溶液进行滴定,相关数据记录如下表所示.
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
②Na2S2O3•5H2O在产品中的质量分数是90.2%(Na2S2O3•5H2O的式量为248,计算结果保留1位小数).
10.25℃时,弱酸的电离平衡常数如下表,下列说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 |
| A. | 向NaCN 溶液中通入少量CO2发生的离子反应为:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大 于a | |
| D. | NaHCO3和Na2CO3的混合溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
17.下列各组离子能在指定环境中大量共存的是( )
| A. | 在 c(HCO3-)=0.1 mol•L-1 的溶液中:NH4+、AlO2-、Cl-、NO3- | |
| B. | 在由水电离出的 c(H+)=l×l0-12 mol•L-1 的溶液中:Cu2+、ClO-、Na+、SO42- | |
| C. | 在加入铝粉产生 H2 的溶液中:SO42-、NO3-、Na+、NH4+ | |
| D. | 在使红色石蕊试纸变蓝的溶液中:SiO32-、CO32-、Na+、F- |
14.己知:KI溶液在酸性条件下能被空气中的O2氧化,反应的离子方程式为:O2+4I一+4H+=212+2H2O.
(1)某化学小组为探究不同条件对上述反应速率的影响,设计如下实验,完成下表中①和②的内容.
(限选试剂:0.lmol/L硫酸、0.2mol/L硫酸、Imol/L KOH溶液、淀粉溶液)
(2)在上述实验中,三种溶液混合的顺序最合理的是C(选填下列选项);应记录的内容是溶液从无色变为蓝色所需的时间
A.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
B.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
C.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
(3)在实验中,发现露置在空气中的KI溶液逐渐变黄色.通过查阅资料知:KI溶液在空气中会生成I2和KOH.小组同学对该描述有疑问:I2为何能与KOH共存?为此提出下列假设进行探究:
假设一:常温下,I2和KOH不反应
假设二:溶液碱性弱,I2和KOH不反应
假设三:…
请设计实验验证假设二,完成表中的内容
(限选试剂:1mol/L盐酸、1mol/L KOH溶液、碘水、淀粉溶液)
(1)某化学小组为探究不同条件对上述反应速率的影响,设计如下实验,完成下表中①和②的内容.
(限选试剂:0.lmol/L硫酸、0.2mol/L硫酸、Imol/L KOH溶液、淀粉溶液)
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 淀粉溶液 | 实验目的 | ||
| C(KI) | V | C(H2SO4) | V | ||||
| 1 | 298K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | l组和2组探究②温度对该反应速率的影响;1组和3组探究反应物浓度对该反应速率的影响 |
| 2 | 308K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | |
| 3 | 298K | 1mol/L | 5mL | ①0.2mol/L硫酸 | 5mL | 3滴 | |
A.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
B.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
C.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
(3)在实验中,发现露置在空气中的KI溶液逐渐变黄色.通过查阅资料知:KI溶液在空气中会生成I2和KOH.小组同学对该描述有疑问:I2为何能与KOH共存?为此提出下列假设进行探究:
假设一:常温下,I2和KOH不反应
假设二:溶液碱性弱,I2和KOH不反应
假设三:…
请设计实验验证假设二,完成表中的内容
| 实验方案 | 预期实验现象与结论 |
| 取少量碘水于试管中,滴入几滴淀粉 溶液,然后逐滴加入1mol/L KOH溶液,观察现象 | 若蓝色不褪色,则假设二正确 |
15.A、B、C、D、E为原子序数依次增大的五种短周期元素.A的质子总数与电子层数相同,B、C、D同周期且相邻,E原子核外电子数是D原子最外层电子数的2倍.C与其同主族的短周期元素可形成常见气体甲.A、B、C3种元素形成化合物乙.下列说法正确的是( )
| A. | 原子半径:E>B>C>D | |
| B. | A分别与B、C、D、E形成的简单化合物中,稳定性最好的和沸点最高的都是AD | |
| C. | E单质性质稳定,但其元素在自然界只能以化合态形式存在 | |
| D. | 化合物乙中一定含有共价键,可能含有离子键 |