题目内容
12.化学与生产、生活、社会密切相关.下列有关说法正确的是( )| A. | 天津港爆炸残留的剧毒物 NaCN,利用双氧水将其氧化为 NaHCO3 和 NH3降低毒性 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5 微粒均具有丁达尔效应 | |
| C. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| D. | 氢氧化钠可作胃酸的中和剂 |
分析 A.氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3;
B.胶体分散系具有丁达尔效应;
C.二氧化硅可以和唯一的酸HF酸反应;
D.氢氧化钠是强碱具有强腐蚀作用;
解答 解:A.碱性气体为氨气,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,反应的化学方程式为:NaCN+H2O2+H2O=NaHCO3+NH3,降低毒性,故A正确;
B.水玻璃是硅酸钠的水溶液,无丁达尔效应,故B错误;
C.二氧化硅可以和唯一的酸HF酸反应,可以用石英制造耐酸容器,但是不能盛氢氟酸,故C错误.
D.氢氧化钠的腐蚀性过强,对胃的刺激性过大,不能用于治疗胃酸过多,故D错误.
故选A.
点评 本题考查较为综合,涉及氰化物、胶体、二氧化硅、氢氧化钠的性质等知识,为高频考点,有利于培养学生的良好的科学素养,提高学生的学习的积极性,难度不大.

练习册系列答案
相关题目
7.硫酸亚铁铵晶体[化学式为x(NH4)2SO4•yFeSO4•zH2O]呈浅绿色,易溶于水,不溶于酒精,是一种重要的化学试剂.某化学兴趣小组设计以下实验制备并定量测定其组成.
已知:
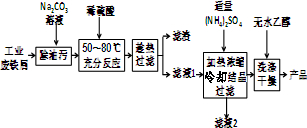
Ⅰ.硫酸亚铁铵晶体的制备(如图所示)
(1)Na2CO3溶液能用于除油污的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-.
(2)加入适量(NH4)2SO4后,经加热浓缩、冷却结晶、过滤就能得到硫酸亚铁铵晶体的原因是相同温度下,硫酸亚铁铵晶体在水中的溶解度小于(NH4)2SO4、FeSO4•7H2O.
(3)用无水乙醇除去硫酸亚铁铵晶体表面的水分,而不能在空气中直接烘干的原因是防止在加热过程中晶体失去结晶水及被氧化.
Ⅱ.定量测定硫酸亚铁铵晶体的组成
步骤1:结晶水的测定
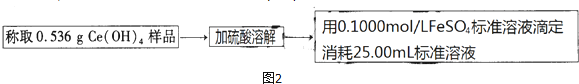
(4)准确称量47.040g纯净的硫酸亚铁铵晶体并隔绝空气加热至恰好失去结晶水,称得剩余固体34.080g,则n(结晶水)=0.72mol.再将全部剩余固体溶于水配成250mL溶液.
步骤2:Fe2+的测定
(5)取25.00mL步骤1中所配溶液于锥形瓶中,将0.1000mol/L 酸性高锰酸钾标准溶液装入
酸式滴定管中进行滴定,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,滴定至终点的现象是滴入最后一滴标准液时,锥形瓶内溶液变为紫红色,且半分钟不恢复原色,共计消耗酸性高锰酸钾标准溶液24.00mL.
步骤3:SO42-的测定 向25.00mL步骤1中所配溶液中加入足量BaCl2溶液后,经过滤、洗涤、干燥后,称量沉淀质量为5.592g.
步骤4:计算
(6)x:y:z=1:1:6.
已知:
| 温度、溶解度、物质 | (NH4)2SO4 | FeSO4•7H2SO4 | 硫酸亚铁铵晶体 |
| 10 | 73.0 | 40.0 | 18.1 |
| 20 | 75.4 | 48.0 | 21.1 |
| 30 | 78.0 | 60.0 | 24.5 |
| 40 | 81.0 | 73.3 | 27.9 |
| 50 | 84.5 | - | 31.3 |
| 70 | 91.9 | - | 38.5 |

Ⅰ.硫酸亚铁铵晶体的制备(如图所示)
(1)Na2CO3溶液能用于除油污的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-.
(2)加入适量(NH4)2SO4后,经加热浓缩、冷却结晶、过滤就能得到硫酸亚铁铵晶体的原因是相同温度下,硫酸亚铁铵晶体在水中的溶解度小于(NH4)2SO4、FeSO4•7H2O.
(3)用无水乙醇除去硫酸亚铁铵晶体表面的水分,而不能在空气中直接烘干的原因是防止在加热过程中晶体失去结晶水及被氧化.
Ⅱ.定量测定硫酸亚铁铵晶体的组成
步骤1:结晶水的测定
(4)准确称量47.040g纯净的硫酸亚铁铵晶体并隔绝空气加热至恰好失去结晶水,称得剩余固体34.080g,则n(结晶水)=0.72mol.再将全部剩余固体溶于水配成250mL溶液.
步骤2:Fe2+的测定
(5)取25.00mL步骤1中所配溶液于锥形瓶中,将0.1000mol/L 酸性高锰酸钾标准溶液装入
酸式滴定管中进行滴定,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,滴定至终点的现象是滴入最后一滴标准液时,锥形瓶内溶液变为紫红色,且半分钟不恢复原色,共计消耗酸性高锰酸钾标准溶液24.00mL.
步骤3:SO42-的测定 向25.00mL步骤1中所配溶液中加入足量BaCl2溶液后,经过滤、洗涤、干燥后,称量沉淀质量为5.592g.
步骤4:计算
(6)x:y:z=1:1:6.
17.下列各组离子能在指定环境中大量共存的是( )
| A. | 在 c(HCO3-)=0.1 mol•L-1 的溶液中:NH4+、AlO2-、Cl-、NO3- | |
| B. | 在由水电离出的 c(H+)=l×l0-12 mol•L-1 的溶液中:Cu2+、ClO-、Na+、SO42- | |
| C. | 在加入铝粉产生 H2 的溶液中:SO42-、NO3-、Na+、NH4+ | |
| D. | 在使红色石蕊试纸变蓝的溶液中:SiO32-、CO32-、Na+、F- |
1.X、Y、Z为三种气体,把a mol X与b mol Y充入一密闭容器中,发生反应X+2Y?2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )
| A. | $\frac{ab}{5}$×100% | B. | $\frac{2ab}{5}$×100% | C. | $\frac{2ab}{5b}$×100% | D. | $\frac{ab}{5a}$×100% |


 氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物.
氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物.