题目内容
工业上常用焦炭和二氧化硅在电炉中发生反应制取粗硅,化学方程式;SiO2+2C
Si+2CO.下列说法不正确的是( )
| ||
| A、该反应属于置换反应 |
| B、C是还原剂,发生还原反应 |
| C、SiO2是氧化剂,在反应中还原 |
| D、氧化还原反应的实质是电子的转移 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:反应SiO2+2C
Si+2CO中,Si元素化合价降低,被还原,C元素化合价升高,被氧化,SiO2为氧化剂,C为还原剂,以此解答该题.
| ||
解答:
解:A.反应特征为一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应,故A正确;
B.反应中C元素化合价升高,被氧化,为还原剂,故B错误;
C.反应中Si元素化合价降低,被还原,SiO2是氧化剂,故C正确;
D.氧化还原反应的特征是元素化合价的升降,本质是电子的转移,故D正确.
故选B.
B.反应中C元素化合价升高,被氧化,为还原剂,故B错误;
C.反应中Si元素化合价降低,被还原,SiO2是氧化剂,故C正确;
D.氧化还原反应的特征是元素化合价的升降,本质是电子的转移,故D正确.
故选B.
点评:本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握元素化合价的判断,从化合价的角度认识相关概念和物质的性质,难度不大.

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
下列性质的比较正确的是( )
| A、酸性:H2SiO3>H2CO3 |
| B、碱性:Mg(OH)2>Al(OH)3 |
| C、稳定性:SiH4>PH3 |
| D、原子半径:N>C |
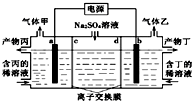 电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )
电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )| A、a极与电源的负极相连 |
| B、产物丙为硫酸溶液 |
| C、离子交换膜d为阳离子交换膜(允许阳离子通过) |
| D、a电极反应式为2H2O+2e-═2OH-+H2↑ |
0.5mol CH4完全燃烧生成CO2和液态H2O时,放出445kJ的热量,则下列热化学方程式中正确的是( )
| A、CH4(g)+2O2(g)=CO2(g)+4H2O(g)△H=-890 kJ/mol | ||||
| B、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890 kJ/mol | ||||
| C、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890 kJ/mol | ||||
D、
|
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、1molNa2O和Na2O2混合物中含阴离子的总数为NA |
| B、标准状况下,22.4 LCCl4含CCl4分子为NA |
| C、1mol H3O+含质子数为10 NA |
| D、1 L0.1 mol?L-1的CuCl2溶液中含Cu2+为0.1NA |
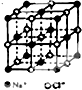 氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示.
氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示.