题目内容
智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:2NaIO3+5NaHSO3═3NaHSO4+2Na2SO4+I2+H2O
(1)反应中 元素被氧化, 是氧化剂,1mol氧化剂转移电子数
(2)用单线桥表示该反应电子转移的方向和数目 .
(1)反应中
(2)用单线桥表示该反应电子转移的方向和数目
考点:氧化还原反应的计算,氧化还原反应的电子转移数目计算
专题:
分析:2NaIO3+5NaHSO3=3NaHSO4+2NaSO4+I2+H2O中,I元素的化合价由+5价降低为0,S元素的化合价由+4价升高为+6价,以此来解答.
解答:
解:(1)反应中S元素的化合价升高,则S元素失去电子被氧化,I元素的化合价降低,则NaIO3为氧化剂,由化合价变化可知1mol氧化剂转移5mol电子,转移的电子数为5NA,
故答案为:S;NaIO3;5;
(2)该反应中转移10e-,单线桥标出电子转移方向和数目为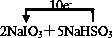 ,故答案为:
,故答案为: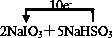 .
.
故答案为:S;NaIO3;5;
(2)该反应中转移10e-,单线桥标出电子转移方向和数目为
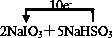 ,故答案为:
,故答案为: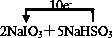 .
.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意从化合价角度分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y?2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
| A、33% | B、40% |
| C、50% | D、67% |
从海带中提取碘用到过滤、萃取操作,进行这两项操作时不需要的仪器是( )
| A、烧杯 | B、烧瓶 |
| C、玻璃棒 | D、分液漏斗 |
工业上常用焦炭和二氧化硅在电炉中发生反应制取粗硅,化学方程式;SiO2+2C
Si+2CO.下列说法不正确的是( )
| ||
| A、该反应属于置换反应 |
| B、C是还原剂,发生还原反应 |
| C、SiO2是氧化剂,在反应中还原 |
| D、氧化还原反应的实质是电子的转移 |
下列关于钠的叙述中不正确的是( )
| A、钠具有很强的还原性 |
| B、钠原子的最外层只有一个电子 |
| C、在实验室中,钠通常保存在石蜡油或煤油中 |
| D、钠在常温下不易被氧化 |
下列有关物质的性质和该性质的应用均正确的是( )
| A、浓硫酸具有吸水性,可用于干燥氨气、二氧化碳等气体 |
| B、二氧化硫有漂白性,可用于加工食品使食品增白 |
| C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D、铝具有良好的导电性,钢抗拉强度大,钢芯铝绞线可用作远距离高压输电线材料 |
N2O俗称“笑气”,曾用作可吸入性麻醉剂.用以下反应可制取N2O:CO+NO2→CO2+N2O.下列说法正确的是( )
| A、反应中每生成1 mol N2O,消耗1.5 mol CO |
| B、等物质的量的N2O和CO2含有相等的电子数 |
| C、N2O只具有氧化性,无还原性 |
| D、反应中每生成1 mol N2O,电子转移的物质的量为3 mol |