题目内容
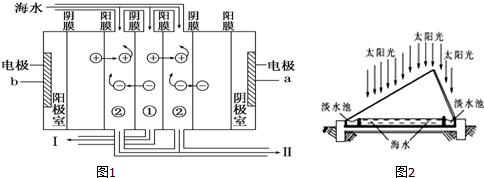
7. 电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).
电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).(1)若用NO2气体进行模拟电解法吸收实验.
①写出电解时NO2发生反应的电极反应式:NO2-e-+H2O=NO3-+2H+.
②若有标准状况下2.24LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为0.1mol.
(2)某小组在右室装有10L 0.2mol•L-1硝酸,用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验.
①实验前,配制10L 0.2mol•L-1硝酸溶液,需量取142.9mL的密度为1.4g•mL-1、质量分数为63%的浓硝酸.
②电解过程中,有部分NO转化为HNO2.实验结束时,测得右室溶液中含3molHNO3、0.1molHNO2,同时左室收集到标准状况下28L H2.计算原气体中NO和NO2的体积比(假设尾气中不含氮氧化物,写出计算过程,没有过程不得分).
分析 (1)①根据图知,电解时,左室中电极上氢离子放电生成氢气,则左室为阴极室,右室为阳极室,阳极上通入的是氮氧化物,生成的硝酸,所以阳极上氮氧化物失电子和水生成硝酸;
②n(NO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,阳极反应式为NO2-e-+H2O=NO3-+2H+,有0.2mol氢离子生成,因为有0.1mol硝酸生成,则有0.1mol氢离子引入阴极室;故答案为:0.1;
(2)①浓硝酸的物质的量浓度=$\frac{1000ρw}{M}$=$\frac{1000×1.4×63%}{63}$mol/L=14mol/L,根据溶液稀释前后溶质的物质的量不变计算;
②n(H2)=$\frac{28L}{22.4L/mol}$=1.25mol,根据转移电子守恒得转移电子物质的量=1.25mol×2=2.5mol,
电解前溶液中n(HNO3)=0.2mol/L×10L=2mol,电解后溶液中含3mol HNO3、0.1molHNO2,说明电解过程中有1mol HNO3、0.1molHNO2生成,
根据N原子守恒得n(NO)+n(NO2)=3 mol-0.2 mol•L-1×10 L+0.1 mol=1.1 mol,
生成0.1mol亚硝酸转移电子0.1mol且需要0.1mol电子,则生成硝酸转移电子物质的量=2.5mol-0.1mol=2.4mol,
设参加反应生成硝酸的NO物质的量为xmol、二氧化氮的物质的量为ymol,根据N原子守恒及转移电子守恒计算.
解答 解:(1)①根据图知,电解时,左室中电极上氢离子放电生成氢气,则左室为阴极室,右室为阳极室,阳极上通入的是氮氧化物,生成的硝酸,所以阳极上氮氧化物失电子和水生成硝酸,电极反应式为NO2-e-+H2O=NO3-+2H+,
故答案为:NO2-e-+H2O=NO3-+2H+;
②n(NO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,阳极反应式为NO2-e-+H2O=NO3-+2H+,有0.2mol氢离子生成,因为有0.1mol硝酸生成,则有0.1mol氢离子引入阴极室,故答案为:0.1;
(2)①浓硝酸的物质的量浓度=$\frac{1000ρw}{M}$=$\frac{1000×1.4×63%}{63}$mol/L=14mol/L,根据溶液稀释前后溶质的物质的量不变计算,所以浓硝酸体积=$\frac{0.2mol/L×10L}{14mol/L}$=142.9mL,故答案为:142.9;
②n(H2)=$\frac{28L}{22.4L/mol}$=1.25mol,根据转移电子守恒得转移电子物质的量=1.25mol×2=2.5mol,
电解前溶液中n(HNO3)=0.2mol/L×10L=2mol,电解后溶液中含3mol HNO3、0.1molHNO2,说明电解过程中有1mol HNO3、0.1molHNO2生成,
根据N原子守恒得n(NO)+n(NO2)=3 mol-0.2 mol•L-1×10 L+0.1 mol=1.1 mol,
生成0.1mol亚硝酸转移电子0.1mol且需要0.1mol电子,则生成硝酸转移电子物质的量=2.5mol-0.1mol=2.4mol,
设参加反应生成硝酸的NO物质的量为xmol、二氧化氮的物质的量为ymol,根据N原子守恒及转移电子守恒得:x+y=1.1-0.1,3x+y=2.4,解得x=0.7,y=0.3,
n(NO):n(NO2)=(0.7+0.1)mol:0.3mol=8:3,相同条件下气体的体积之比等于物质的量之比,所以NO和二氧化氮的体积之比为8:3,
故答案为,8:3.
点评 本题考查电解原理,为高频考点,侧重考查学生分析计算能力,明确各个电极上发生的反应及反应中存在的守恒是解本题关键,注意(2)②中电解后的硝酸还包含原来的硝酸,为易错点.

| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 容器内总质量 | D. | 气体的总物质的量 |
| A. | 1molCu与足量的S反应转移电子数为2NA | |
| B. | 46g有机物C2H6O中含有共价键的数目为7NA | |
| C. | 在0.5L2mol•L-1的Na2CO3溶液中含CO32-的数目为NA | |
| D. | 10gD2O和H218O的混合物中含有的中子数为5NA |
| A. | 工业上现在大规模采用电解熔融NaCl或AlCl3制取Na或Al | |
| B. | 若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | 某反应的平衡常数K300℃>K350℃,则该反应△H<0 | |
| D. | 合成氨生产中将NH3液化分离,目的是加快正反应速率,提高H2的转化率 |
| A. | 检查容量瓶瓶口是否漏水的方法是:往瓶内加入一定量水,塞好瓶塞.用食指摁住瓶塞,另一只手托住瓶底,把瓶倒转过来,观察瓶塞周围是否有水漏出即可 | |
| B. | 向装有2mL 2mol/L AlCl3溶液的试管中,逐滴加入0.01mol/L氨水3mL,产生沉淀且沉淀不溶解,说明氢氧化铝不溶于弱碱 | |
| C. | 用浓硫酸配制一定浓度的稀硫酸时,用量筒量取浓硫酸倒入盛水的烧杯中稀释,并用水洗涤量筒,洗涤液一并倒入烧杯中 | |
| D. | 如果不慎将酸粘到皮肤或衣物上,立即用较多的水冲洗,再用3%~5%的NaHCO3溶液来冲洗 |

下列说法正确的是( ):
| A. | 原溶液中一定存在的离子为NH4+、Fe2+、NO3-和SO42- | |
| B. | 无法确定原试液中是否含有Fe3+、K+ | |
| C. | 滤液X中大量存在的阳离子有NH4+、Fe3+、H+和Al3+ | |
| D. | 无法确定沉淀B的成分 |
| A. | 需要加热的化学反应都是吸热反应 | |
| B. | 水力发电是将化学能转化为电能的过程 | |
| C. | 可以通过化学反应完成16O到18O的转变 | |
| D. | 生铁、不锈钢、青铜都属于合金 |
| A. | 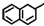 中所有碳原子可能在同一平面上 中所有碳原子可能在同一平面上 | |
| B. | 丙烷中所有的原子均在一个平面 | |
| C. | C4H8属于烯烃的同分异构体共有4种(含顺反异构) | |
| D. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 |