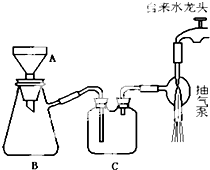
题目内容
19.某试液中只可能含有K+、NH4+、Fe2+、Fe3+、Cl-、SO42-、NO3-、AlO2- 中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验: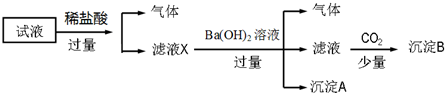
下列说法正确的是( ):
| A. | 原溶液中一定存在的离子为NH4+、Fe2+、NO3-和SO42- | |
| B. | 无法确定原试液中是否含有Fe3+、K+ | |
| C. | 滤液X中大量存在的阳离子有NH4+、Fe3+、H+和Al3+ | |
| D. | 无法确定沉淀B的成分 |
分析 试液中加入盐酸产生气体,说明一定含有硝酸根离子和二价铁离子;滤液中加入氢氧化钡生成沉淀,说明一定含有氨根离子,因为加入盐酸,在酸性环境下二价铁离子被氧化生成三价铁,产生氢氧化铁沉淀,二价铁离子与偏铝酸根离子发生双水解,不共存,所以一定不含有偏铝酸根离子,加入氢氧化钡溶液产生气体,则一定含有氨根离子,产生沉淀A,该沉淀可能是氢氧化铁或者硫酸钡,滤液中含有大量钡离子、氢氧根离子,通入二氧化碳,得到沉淀B为碳酸钡沉淀,因为存在的离子浓度均为0.1mol•L-1,从电荷的角度出发,判断是否含有钾离子和硫酸根离子,据此解答.
解答 解:试液中加入盐酸产生气体,硝酸根离子、二价铁离子在酸性环境下发生氧化还原反应生成三价铁离子和一氧化氮,说明一定含有硝酸根离子、二价铁离子;二价铁离子与偏铝酸根离子发生双水解不共存,一定不含偏铝酸根离子,向滤液中加入足量氢氧化钡,产生气体,氢氧根离子与氨根离子反应生成氨气,一定含有氨根离子,因为第一步反应中生成三价铁离子,所以加入氢氧化钡会产生氢氧化铁沉淀或者硫酸钡,滤液中含有大量钡离子、氢氧根离子,通入二氧化碳,得到沉淀B为碳酸钡沉淀,因为存在的离子浓度均为0.1mol•L-1,依据溶液中阴阳离子所带电荷守恒可知:硫酸根离子一定存在;三价铁离子,一定不存在;
一定不存在的是:Fe3+、AlO2-;
所以一定含有的离子有:NH4+、Fe2+、NO3-、SO42-;
无法确定的是:K+、Cl-,
A.原溶液中一定存在的离子为NH4+、Fe2+、NO3-、SO42-,故A正确;
B.通过实验现象无法确定是否含有Cl-、K+,故B错误;
C.滤液X中大量存在的阳离子有NH4+、H+、Fe2+,不含有铝离子,故C错误;
D.沉淀B的成分为碳酸钡沉淀,故D错误;
故选:A.
点评 本题考查了常见离子的性质检验,熟悉离子的性质及检验方式是解题关键,题目难度中等.

 初中暑期衔接系列答案
初中暑期衔接系列答案| A. | 塑料 | B. | 玻璃 | C. | 淀粉 | D. | 合成纤维 |
部分难溶电解质的性质如表:
| 物质 | Kap(25℃) | 颜色 |
| PbSO4 | 1.8×10-8 | 白色 |
| PbCO3 | 1.5×10-13 | 白色 |
| PbCrO4 | 1.8×10-14 | 黄色 |
| BaCrO4 | 1.2×10-10 | 黄色 |
| Pb(OH)2 | 1.8×10-20 | 白色 |
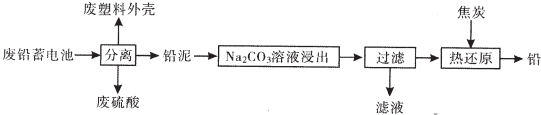
(1)在生产、生活中使用广泛,铅蓄电池的缺点有比能量低(写一条).
(2)燃烧废塑料外壳可以发电,其一系列能量转换过程:化学能→热能→机械能→电能.
(3)将流程图中的废硫酸和滤液按一定比例混合,再将所得的混台液经蒸发浓缩、冷却结晶等操作,可以析出十水硫酸钠晶体.
(4)利用铅泥中的PbS04溶于CH3COONa溶液生成弱电解质(CH3COO)2Pb,(CH3COO)2Pb溶液与KC10在强碱性条件下反应制取Pb02,写出后一步生成PbO2的离子方程式(CH3COO)2Pb+ClO-+2OH-=Pb02↓+Cl-+2CH3COO-+H2O.
(5)25aC时,Na2CO3溶液浸出时发生的反应为:CO32-(aq)+PbSO4(s)?PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=1.2×10-5.以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程PbCO3$\frac{\underline{\;\;△\;\;}}{\;}$PbO+CO2↑、2PbO$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+CO2↑
(6)已知Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物.设计实验区别PbCr04和BaCr04取少量待测物于两支试管中,分别与过量KOH溶液反应,能溶解的是PbCr04,不溶解的是BaCr04.
| A. | 减压过滤不宜用于过滤胶状沉淀或颗粒太小的沉淀,沉淀的颗粒较大时,可用倾析法将固体与溶液分离 | |
| B. | 制备阿司匹林时,将反应物置于水浴85~90℃的锥形瓶中充分反应5~10min,冷却后,向锥形瓶中加一定量的水可以促进产物的析出 | |
| C. | 海带灼烧成灰烬后,加水煮沸2~3min并过滤,滤液中可加入适量的H2O2来氧化I- | |
| D. | 将3~4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸,若出现白色沉淀,说明含有氯元素 |
| A. | 保持体积不变,充入水蒸气使体系压强增大 | |
| B. | 将容器体积缩小一倍 | |
| C. | 增加C的量 | |
| D. | 加入催化剂 |
| A. | 甲醛的电子式: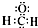 | |
| B. | 苯酚钠溶液中中通入少量二氧化碳气体: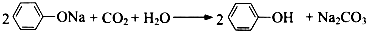 | |
| C. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-$→_{△}^{H_{2}O}$CH2=CH2↑+Br-+H2O | |
| D. | 乙醇与灼热的氧化铜反应:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O |
| A. | 1L0.1 mol/L氨水中含有0.1NA NH3分子 | |
| B. | 46gNO2和N2O4混合气体中含有的原子数为3NA | |
| C. | 标准状况下,11.2 L CCl4中含有的分子数为0.5NA | |
| D. | 常温常压下,12g 14C所含原子数为NA |
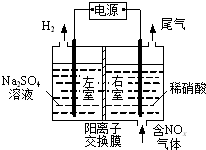 电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).
电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).