题目内容
17.下列各项中正确的是( )| A. | 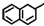 中所有碳原子可能在同一平面上 中所有碳原子可能在同一平面上 | |
| B. | 丙烷中所有的原子均在一个平面 | |
| C. | C4H8属于烯烃的同分异构体共有4种(含顺反异构) | |
| D. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 |
分析 A.甲烷是正四面体结构;
B.丙烷含有甲基,具有甲烷的四面体结构;
C.烯烃具有顺反异构,C=C双键不饱和的同一C原子上连接2个不同的原子或原子团,据此书写判断;
D.聚氯乙烯中不含有碳碳双键,苯分子中不含有碳碳双键.
解答 解:A.甲烷是正四面体结构,与甲基相连的饱和碳原子与周围的3个碳不在同一平面上,故A错误;
B.丙烷含有甲基,具有甲烷的四面体结构,所有的原子不可能在一个平面,故B错误;
C.C4H8中属于烯烃的同分异构体有CH2═CH-CH2CH3、CH2=C(CH3)2、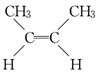 、
、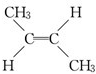 ,故符合条件的同分异构体有4种,故C正确;
,故符合条件的同分异构体有4种,故C正确;
D.聚氯乙烯的结构简式为: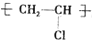 ,聚氯乙烯中不含碳碳双键,苯中不含有碳碳双键,故D错误.
,聚氯乙烯中不含碳碳双键,苯中不含有碳碳双键,故D错误.
故选C.
点评 本题考查有机物的结构、命名、同分异构体的书写,难度不大,注意烯烃具有顺反异构,满足C=C双键不饱和的同一C原子上连接2个不同的原子或原子团.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
8.下列化学用语表述一定正确的是( )
| A. | 甲醛的电子式: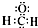 | |
| B. | 苯酚钠溶液中中通入少量二氧化碳气体: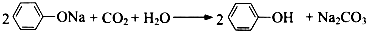 | |
| C. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-$→_{△}^{H_{2}O}$CH2=CH2↑+Br-+H2O | |
| D. | 乙醇与灼热的氧化铜反应:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O |
5.硒为第四周期VIA族元素,根据它在周期表中位置推测,硒不可能具有的性质( )
| A. | 单质有还原性 | B. | 硒元素在化合物中可显-2价 | ||
| C. | 硒化氢水溶液显弱碱性 | D. | 最高价氧化物的水化物显酸性 |
12.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 甲苯与氯气在光照下反应主要生成2,4二氯甲苯 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2二溴乙烷 | |
| D. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 |
2.下列化学用语表示正确的是( )
| A. | 甲烷的比例模型: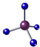 | B. | O2与O22-互为同分异构体 | ||
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同素异形体 | D. | S2-的结构示意图: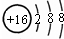 |
9.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1L0.1 mol/L氨水中含有0.1NA NH3分子 | |
| B. | 46gNO2和N2O4混合气体中含有的原子数为3NA | |
| C. | 标准状况下,11.2 L CCl4中含有的分子数为0.5NA | |
| D. | 常温常压下,12g 14C所含原子数为NA |
6.表是几种常用燃料的燃烧热:1mol燃料完全燃烧(生成物中的H2O为液态)时放出的热量.
(1)从热量角度分析,目前最适合家庭使用的优质气体燃料是甲烷.
(2)写出乙醇完全燃烧的热化学方程式C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1367KJ/mol.
| 物质 | 炭粉 | 一氧化碳 | 氢气 | 甲烷 | 乙醇 |
| 状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
| 热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1367 |
(2)写出乙醇完全燃烧的热化学方程式C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1367KJ/mol.
7. 已知下列反应:
已知下列反应:
①2Fe3++2I-?2Fe2++I2(s)(慢)
②I2+2S2O32-═2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的FeCl3溶液,为确保能观察到溶液呈蓝色的现象,S2O32-与Fe3+初始的物质的量需满足的关系为:n(S2O32-):n(Fe3+)<1.
(2)已知Fe3+与I-在水溶液中发生反应①,该反应的正反应速率和I-、Fe3+的浓度关系为v=kcm(I-)•cn(Fe3+)(其中k为常数).
①则该反应①的平衡常数表达式为K=$\frac{{c}^{2}(F{e}^{2+})}{{c}^{2}({I}^{-}){c}^{2}(F{e}^{3+})}$;
②由上表数据可知:I-浓度对反应速率的影响大于Fe3+浓度对反应速率的影响(填“大于”“小于”或“等于”);
③达到平衡后,往反应混合液中加入一定量的CCl4,则上述平衡向右移动(填“向左”、“向右”、“不会”).
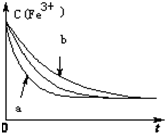
(3)已知反应①在其它条件不变的情况下,只改变一个条件,浓度c(Fe3+)与反应时间t的变化曲线如图所示.则
①曲线a改变的条件是:加入催化剂
②曲线b改变的条件是:降低反应温度
(4)用KSCN溶液检验FeCl3溶液的化学方程式为:FeCl3+3KSCN?Fe(SCN)3(血红色)+3KCl
则达到平衡后下列措施可使溶液颜色变浅的是BC
A.加入少量KCl晶体 B.加入少量Na2SO3晶体
C.加入少量Na2CO3溶液 D.加入较浓的KSCN溶液
(5)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,Kw=1×10-14,则该温度下反应:Fe (OH)3+3H+?Fe3++3H2O达平衡时$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=2.79×103.
 已知下列反应:
已知下列反应:①2Fe3++2I-?2Fe2++I2(s)(慢)
②I2+2S2O32-═2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的FeCl3溶液,为确保能观察到溶液呈蓝色的现象,S2O32-与Fe3+初始的物质的量需满足的关系为:n(S2O32-):n(Fe3+)<1.
(2)已知Fe3+与I-在水溶液中发生反应①,该反应的正反应速率和I-、Fe3+的浓度关系为v=kcm(I-)•cn(Fe3+)(其中k为常数).
| cm(I-)(mol/L)m | cn(Fe3+)[(mol/L)n] | v[mol/(L•s)] | |
| a | 0.20 | 0.80 | 0.032 |
| b | 0.60 | 0.40 | 0.144 |
| c | 0.80 | 0.20 | 0.128 |
②由上表数据可知:I-浓度对反应速率的影响大于Fe3+浓度对反应速率的影响(填“大于”“小于”或“等于”);
③达到平衡后,往反应混合液中加入一定量的CCl4,则上述平衡向右移动(填“向左”、“向右”、“不会”).
(3)已知反应①在其它条件不变的情况下,只改变一个条件,浓度c(Fe3+)与反应时间t的变化曲线如图所示.则
①曲线a改变的条件是:加入催化剂
②曲线b改变的条件是:降低反应温度
(4)用KSCN溶液检验FeCl3溶液的化学方程式为:FeCl3+3KSCN?Fe(SCN)3(血红色)+3KCl
则达到平衡后下列措施可使溶液颜色变浅的是BC
A.加入少量KCl晶体 B.加入少量Na2SO3晶体
C.加入少量Na2CO3溶液 D.加入较浓的KSCN溶液
(5)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,Kw=1×10-14,则该温度下反应:Fe (OH)3+3H+?Fe3++3H2O达平衡时$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=2.79×103.
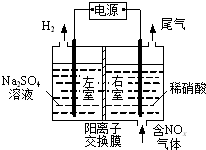 电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).
电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).