题目内容
2.下列有关说法正确的是( )| A. | 工业上现在大规模采用电解熔融NaCl或AlCl3制取Na或Al | |
| B. | 若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | 某反应的平衡常数K300℃>K350℃,则该反应△H<0 | |
| D. | 合成氨生产中将NH3液化分离,目的是加快正反应速率,提高H2的转化率 |
分析 A、氯化铝是分子晶体,熔融物中不存在离子,不能电解熔融物来制备金属铝;
B、铜、铝和电解质溶液易形成原电池,铝易失电子而作负极,铜作正极;
C、根据平衡常数的变化可判断温度对平衡移动的影响;
D、减少生成物的浓度可以使化学平衡正向移动,使反应速率减慢.
解答 解:A、氯化铝是分子晶体,熔融物中不存在离子,不能电解熔融物来制备金属铝,电解氧化铝来制备金属铝,故A错误;
B、铜、铝和电解质溶液易形成原电池,铝易失电子而作负极,铜作正极,加快金属铝的腐蚀速率,会导致金属铝更快被氧化,故B错误;
C、K300℃<K350℃,说明升高温度平衡向正反应方向移动,则正反应放热,△H<0,故C正确;
D、合成氨生产中将NH3液化分离,提高N2、H2的转化率,但是会减慢反应速率,故D错误.
故选C.
点评 本题综合考查电化学原理、反应焓变和吸放热的关系、影响化学反应速率的因素等综合知识,难度中等.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
13.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.lmol/LCH3COONa溶液:c(Na+)═c(CH3COO-) | |
| B. | 0.1mol/LNa2CO3溶液:c(Na+)═c(HCO3-)+2c(CO32-)+2c(H2CO3) | |
| C. | 向醋酸钠溶液加适量醋酸所得溶液:c(Na+)+c(H+)═c(CH3COO-)+c(OH-) | |
| D. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合:c(Cl-)>c(NH4+) |
10.废铅蓄电池的一种回收利用工艺流程如图所示:
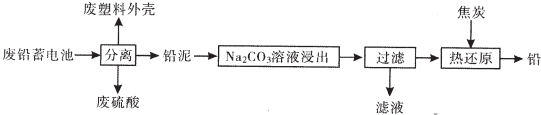
部分难溶电解质的性质如表:
回答下列问题:
(1)在生产、生活中使用广泛,铅蓄电池的缺点有比能量低(写一条).
(2)燃烧废塑料外壳可以发电,其一系列能量转换过程:化学能→热能→机械能→电能.
(3)将流程图中的废硫酸和滤液按一定比例混合,再将所得的混台液经蒸发浓缩、冷却结晶等操作,可以析出十水硫酸钠晶体.
(4)利用铅泥中的PbS04溶于CH3COONa溶液生成弱电解质(CH3COO)2Pb,(CH3COO)2Pb溶液与KC10在强碱性条件下反应制取Pb02,写出后一步生成PbO2的离子方程式(CH3COO)2Pb+ClO-+2OH-=Pb02↓+Cl-+2CH3COO-+H2O.
(5)25aC时,Na2CO3溶液浸出时发生的反应为:CO32-(aq)+PbSO4(s)?PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=1.2×10-5.以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程PbCO3$\frac{\underline{\;\;△\;\;}}{\;}$PbO+CO2↑、2PbO$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+CO2↑
(6)已知Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物.设计实验区别PbCr04和BaCr04取少量待测物于两支试管中,分别与过量KOH溶液反应,能溶解的是PbCr04,不溶解的是BaCr04.

部分难溶电解质的性质如表:
| 物质 | Kap(25℃) | 颜色 |
| PbSO4 | 1.8×10-8 | 白色 |
| PbCO3 | 1.5×10-13 | 白色 |
| PbCrO4 | 1.8×10-14 | 黄色 |
| BaCrO4 | 1.2×10-10 | 黄色 |
| Pb(OH)2 | 1.8×10-20 | 白色 |
(1)在生产、生活中使用广泛,铅蓄电池的缺点有比能量低(写一条).
(2)燃烧废塑料外壳可以发电,其一系列能量转换过程:化学能→热能→机械能→电能.
(3)将流程图中的废硫酸和滤液按一定比例混合,再将所得的混台液经蒸发浓缩、冷却结晶等操作,可以析出十水硫酸钠晶体.
(4)利用铅泥中的PbS04溶于CH3COONa溶液生成弱电解质(CH3COO)2Pb,(CH3COO)2Pb溶液与KC10在强碱性条件下反应制取Pb02,写出后一步生成PbO2的离子方程式(CH3COO)2Pb+ClO-+2OH-=Pb02↓+Cl-+2CH3COO-+H2O.
(5)25aC时,Na2CO3溶液浸出时发生的反应为:CO32-(aq)+PbSO4(s)?PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=1.2×10-5.以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程PbCO3$\frac{\underline{\;\;△\;\;}}{\;}$PbO+CO2↑、2PbO$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+CO2↑
(6)已知Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物.设计实验区别PbCr04和BaCr04取少量待测物于两支试管中,分别与过量KOH溶液反应,能溶解的是PbCr04,不溶解的是BaCr04.
17.化学与人类生活、社会可持续发展密切相关.下列说法正确的是( )
| A. | 福尔马林可作食品的保鲜剂 | |
| B. | 用CO2合成聚碳酸酯可降解塑料,实现碳的循环利用 | |
| C. | “天宫一号”使用的碳纤维,是一种新型有机高分子材料 | |
| D. | 制作快餐饭盒的可降解“玉米塑料”(主要成分是聚乳酸)是纯净物 |
14.下列有关实验操作、现象或实验原理的叙述,错误的是( )
| A. | 减压过滤不宜用于过滤胶状沉淀或颗粒太小的沉淀,沉淀的颗粒较大时,可用倾析法将固体与溶液分离 | |
| B. | 制备阿司匹林时,将反应物置于水浴85~90℃的锥形瓶中充分反应5~10min,冷却后,向锥形瓶中加一定量的水可以促进产物的析出 | |
| C. | 海带灼烧成灰烬后,加水煮沸2~3min并过滤,滤液中可加入适量的H2O2来氧化I- | |
| D. | 将3~4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸,若出现白色沉淀,说明含有氯元素 |
11.反应C(s)+H2O(g)?CO(g)+H2(g)在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 保持体积不变,充入水蒸气使体系压强增大 | |
| B. | 将容器体积缩小一倍 | |
| C. | 增加C的量 | |
| D. | 加入催化剂 |
12.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 甲苯与氯气在光照下反应主要生成2,4二氯甲苯 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2二溴乙烷 | |
| D. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 |

 .
. 或
或 .(任写一种)
.(任写一种)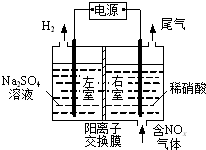 电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).
电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).