题目内容
下列图示与对应的叙述不相符的是( )
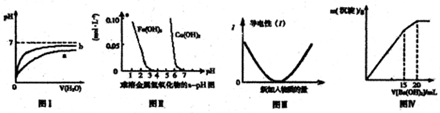

| A、图Ⅰ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线b对应的是盐酸 |
| B、根据图Ⅱ可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO2调节pH在4-5之间即可 |
| C、图Ⅲ可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 |
| D、图Ⅳ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mLBa(OH)2溶液时,沉淀全部是BaSO4 |
考点:酸碱混合时的定性判断及有关ph的计算,电解质溶液的导电性,离子反应发生的条件
专题:图示题
分析:A、加水稀释促进醋酸电离,稀释相同的倍数,醋酸pH变化小于盐酸;
B、根据图可知,Fe3+在pH=1时开始水解,在pH=4时沉淀完全;而在Cu2+在pH=5时开始沉淀,在pH=7时沉淀完全,据此分析;
C、向乙酸溶液中通入氨气,与乙酸反应生成乙酸铵,是强电解质;
D、向明矾溶液中中加入Ba(OH)2生成沉淀的过程分为两个阶段,设KAl(SO4)2的物质的量为1mol,据此分析.
B、根据图可知,Fe3+在pH=1时开始水解,在pH=4时沉淀完全;而在Cu2+在pH=5时开始沉淀,在pH=7时沉淀完全,据此分析;
C、向乙酸溶液中通入氨气,与乙酸反应生成乙酸铵,是强电解质;
D、向明矾溶液中中加入Ba(OH)2生成沉淀的过程分为两个阶段,设KAl(SO4)2的物质的量为1mol,据此分析.
解答:
解:A、加水稀释促进醋酸电离,稀释相同的倍数,醋酸pH变化小于盐酸,所以曲线a对应的是醋酸,故A正确;
B、根据图可知,Fe3+在pH=1时开始水解,在pH=4时沉淀完全;而在Cu2+在pH=5时开始沉淀,在pH=7时沉淀完全,故可以加入CuO2调节pH在4-5之间即除去Fe3+而对Cu2+无影响,故B正确;
C、乙酸溶液中通入氨气,由弱电解质变为强电解质,溶液导电性增强,与图象不符,故C错误;
D、设KAl(SO4)2的物质的量为1mol,则含有1molAl3+,含2molSO42-,故当加入1.5molBa(OH)2时,能使1molAl3+完全沉淀为1molAl(OH)3沉淀,能将1.5molSO42-沉淀为BaSO4;当继续加0.5molBa(OH)2时,能使SO42-沉淀完全,引入的1molOH-能使1molAl(OH)3完全溶解,此时沉淀只有BaSO4,此两个阶段中消耗的Ba(OH)2的物质的量之比为3:1,即加入15mLBa(OH)2溶液时,沉淀为BaSO4和Al(OH)3,当加入20mLBa(OH)2溶液时,沉淀全部是BaSO4,故D正确.
故选C.
B、根据图可知,Fe3+在pH=1时开始水解,在pH=4时沉淀完全;而在Cu2+在pH=5时开始沉淀,在pH=7时沉淀完全,故可以加入CuO2调节pH在4-5之间即除去Fe3+而对Cu2+无影响,故B正确;
C、乙酸溶液中通入氨气,由弱电解质变为强电解质,溶液导电性增强,与图象不符,故C错误;
D、设KAl(SO4)2的物质的量为1mol,则含有1molAl3+,含2molSO42-,故当加入1.5molBa(OH)2时,能使1molAl3+完全沉淀为1molAl(OH)3沉淀,能将1.5molSO42-沉淀为BaSO4;当继续加0.5molBa(OH)2时,能使SO42-沉淀完全,引入的1molOH-能使1molAl(OH)3完全溶解,此时沉淀只有BaSO4,此两个阶段中消耗的Ba(OH)2的物质的量之比为3:1,即加入15mLBa(OH)2溶液时,沉淀为BaSO4和Al(OH)3,当加入20mLBa(OH)2溶液时,沉淀全部是BaSO4,故D正确.
故选C.
点评:本题考查较为综合,以图象题的形式考查,题目难度中等,解答本题的关键是把握物质的性质,易错点为A,注意D为固体的特点.

练习册系列答案
相关题目
工业上生产MnO2和Zn的主要反应有:①MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O②MnSO4+ZnSO4+2H2O
MnO2+Zn+2H2SO4下列说法不正确的是( )
| ||
| A、①中MnO2和H2SO4都是氧化剂 |
| B、MnSO4的还原性小于Zn的还原性 |
| C、②中MnSO4发生氧化反应 |
| D、硫酸在该生产中可循环利用 |
下列实验设计和结论相符的是( )
| A、测定中和热:取25 mL0.25 mol/L的硫酸溶液和25 mL0.5 mol/LNaOH溶液中和,测定反应放出的热 |
| B、在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 |
| C、将SO2与CO2的混合气通过品红溶液洗气后,可除去CO2中的SO2 |
| D、向含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2溶液,充分反应后过滤,可除去Ca(OH)2 |
常温下,有物质的量浓度、体积都相同的NaA(pH=8)和NaB(pH=12)溶液,下列说法不正确的是( )
| A、NaB溶液比NaA溶液更能促进水的电离 |
| B、将两溶液混合,混合溶液中:c(Na+)+c(H+)=c(OH-)+c(A-)+c(B-) |
| C、NaA溶液中:c(Na+)-c(A-)=10-6mol/L |
| D、NaB溶液中:c(H+)+c(HB)=10-2mol/L |
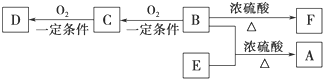
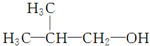 )和甲酸在一定条件下制取E.该反应的化学方程式是
)和甲酸在一定条件下制取E.该反应的化学方程式是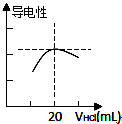 某学习小组利用中和反应原理测定某氨水的物质的量浓度,以测量溶液导电性判断滴定终点.实验步骤如下:
某学习小组利用中和反应原理测定某氨水的物质的量浓度,以测量溶液导电性判断滴定终点.实验步骤如下: