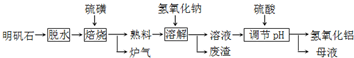
题目内容
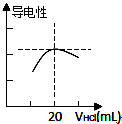 某学习小组利用中和反应原理测定某氨水的物质的量浓度,以测量溶液导电性判断滴定终点.实验步骤如下:
某学习小组利用中和反应原理测定某氨水的物质的量浓度,以测量溶液导电性判断滴定终点.实验步骤如下:(1)用
(2)量取20.00mL上述溶液倒入洁净干燥锥形瓶中.如果锥形瓶中含有少量蒸馏水,是否
(3)向锥形瓶中滴加0.10mol/L的盐酸,图为溶液导电性与加入盐酸体积关系的曲线图.
①氨水与盐酸反应的离子方程式为
②简述判断滴定终点的理由
③该氨水样品的物质的量浓度为
考点:中和滴定,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)氨水为弱碱,应用碱式滴定管(或移液管)量取;
(2)如果锥形瓶中含有少量蒸馏水,虽然待测液的浓度减少,但氨水的物质的量不变,消耗的V(酸)不变;
(3)①根据氨水与盐酸反应生成盐和水书写;
②恰好完全反应时,离子浓度最大,导电能力最强;
③根据溶液的导电性最大时,酸、碱恰好反应,依据关系式HCl~NH3?H2O来计算;
(2)如果锥形瓶中含有少量蒸馏水,虽然待测液的浓度减少,但氨水的物质的量不变,消耗的V(酸)不变;
(3)①根据氨水与盐酸反应生成盐和水书写;
②恰好完全反应时,离子浓度最大,导电能力最强;
③根据溶液的导电性最大时,酸、碱恰好反应,依据关系式HCl~NH3?H2O来计算;
解答:
解:(1)一水合氨在溶液中电离出铵根离子和氢氧根离子,其电离方程式为:NH3?H2O?NH4++OH-,所以用碱式滴定管(或移液管)量取,
故答案为:碱式滴定管(或移液管);
(2)根据c(碱)=
,如果锥形瓶中含有少量蒸馏水,虽然待测液的浓度减少,但氨水的物质的量不变,消耗的V(酸)不变;
故答案为:否;
(3)①氨水与盐酸反应生成氯化铵和水,反应的化学方程式为:NH3?H2O+HCl=(NH4Cl+H2O,离子方程式为:H++NH3?H2O=NH4++H2O,
故答案为:H++NH3?H2O=NH4++H2O;
②氨水为弱碱,盐酸为强酸,恰好完全反应时,生成氯化铵,为请电解质,溶液中离子浓度最大,导电能力最强,
故答案为:恰好完全反应时,离子浓度最大,导电能力最强;
③溶液的导电性最大时,酸、碱恰好反应,
HCl~NH3?H2O
1 1
0.10mol?L-1×20.00mL 20.00mL×C
则配制成100mL待测氨水的物质的量浓度C=0.10mol?L-1,该氨水样品的物质的量浓度为
=1.00mol?L-1;
故答案为:1.00mol?L-1;
故答案为:碱式滴定管(或移液管);
(2)根据c(碱)=
| c(酸)×V(酸) |
| V(碱) |
故答案为:否;
(3)①氨水与盐酸反应生成氯化铵和水,反应的化学方程式为:NH3?H2O+HCl=(NH4Cl+H2O,离子方程式为:H++NH3?H2O=NH4++H2O,
故答案为:H++NH3?H2O=NH4++H2O;
②氨水为弱碱,盐酸为强酸,恰好完全反应时,生成氯化铵,为请电解质,溶液中离子浓度最大,导电能力最强,
故答案为:恰好完全反应时,离子浓度最大,导电能力最强;
③溶液的导电性最大时,酸、碱恰好反应,
HCl~NH3?H2O
1 1
0.10mol?L-1×20.00mL 20.00mL×C
则配制成100mL待测氨水的物质的量浓度C=0.10mol?L-1,该氨水样品的物质的量浓度为
| 0.10mol?L-1×100mL |
| 10mL |
故答案为:1.00mol?L-1;
点评:本题主要考查了中和滴定的操作过程、化学计算以及误差分析,掌握误差分析的原理是解题的关键,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各组溶液等体积混合后,所得溶液pH最大的是( )
| A、0.1mol?L-1NaHCO3溶液与0.1mol?L-1 NaOH溶液 |
| B、0.1mol?L-1NaHSO4溶液与0.1mol?L-1 Ba(OH)2溶液 |
| C、0.2mol?L-1氨水与0.1mol?L-1盐酸 |
| D、0.1mol?L-1氨水与0.1mol?L-1盐酸 |
下列电解质溶液用惰性电极进行电解时,一段时间后,溶液的pH增大的是( )
| A、稀碳酸钠溶液 | B、硫酸钠溶液 |
| C、稀硫酸 | D、硫酸铜溶液 |
下列图示与对应的叙述不相符的是( )
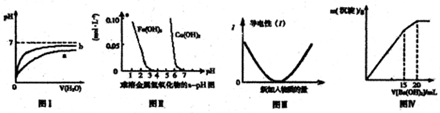

| A、图Ⅰ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线b对应的是盐酸 |
| B、根据图Ⅱ可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO2调节pH在4-5之间即可 |
| C、图Ⅲ可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 |
| D、图Ⅳ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mLBa(OH)2溶液时,沉淀全部是BaSO4 |
下列选项中粒子浓度关系不正确的是( )
| A、Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) |
| B、NaHCO3溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| C、pH=2的盐酸溶液与pH=12的氨水混合所得溶液中:cc(H+)+(NH4+)=c(OH-)+c(Cl-) |
| D、等物质的量的CH3COOH和CH3COONa溶液等体积混合所得溶液中:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) |
C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2.若将2.00g C跟16.0g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12L气体(标准状况),生成沉淀的质量为5.00g.下列说法错误的是( )
| A、反应后的固体混合物中Cu的质量为12.8 g |
| B、反应后的固体混合物中还含有碳 |
| C、反应后的固体混合物总质量为13.6 g |
| D、反应后的固体混合物中氧化物的物质的量为0.05mol |