题目内容
常温下,有100mL pH=12的氨水溶液.
(1)溶液中,NH4+物质的量浓度约为 ,水电离的OH-的物质的量浓度约为 .
(2)向该氨水中加入pH=2的盐酸溶液,至完全中和,消耗盐酸溶液的体积 100mL(填“>”“<”“=”,下同);混合溶液的pH 7,用离子方程式说明理由: .混合溶液中离子浓度由大到小的关系为: .
(3)若向该氨水中加入100mL盐酸,溶液呈中性,原盐酸溶液的pH 2(填“>”、“<”“=”),混合溶液中离子浓度由大到小的关系为: .
(1)溶液中,NH4+物质的量浓度约为
(2)向该氨水中加入pH=2的盐酸溶液,至完全中和,消耗盐酸溶液的体积
(3)若向该氨水中加入100mL盐酸,溶液呈中性,原盐酸溶液的pH
考点:弱电解质在水溶液中的电离平衡
专题:
分析:(1)据一水合氨的电离平衡方程式结合其pH计算;水电离出来的氢离子和氢氧根离子浓度相等;
(2)氢氧根离子浓度为0.01mol/L,则一水合氨的浓度远远大于0.01mol/L,盐酸浓度为0.01mol/L,氨水与盐酸完全中和,即一水合氨的物质的量与盐酸相同,盐酸体积大于氨水;氯化铵溶液因为铵根水解显酸性;可以依据溶液显酸性和电荷守恒书写离子浓度的关系;
(3)氢离子与氢氧根离子浓度相同的氨水和盐酸混合,溶液显碱性;中性溶液中利用电荷守恒判断离子浓度关系.
(2)氢氧根离子浓度为0.01mol/L,则一水合氨的浓度远远大于0.01mol/L,盐酸浓度为0.01mol/L,氨水与盐酸完全中和,即一水合氨的物质的量与盐酸相同,盐酸体积大于氨水;氯化铵溶液因为铵根水解显酸性;可以依据溶液显酸性和电荷守恒书写离子浓度的关系;
(3)氢离子与氢氧根离子浓度相同的氨水和盐酸混合,溶液显碱性;中性溶液中利用电荷守恒判断离子浓度关系.
解答:
解:(1)pH=12的氨水中,有一水合氨电离出来的氢氧根离子和铵根离子浓度相同,都是0.01mol/L;pH=12的氨水中,由水电离出来的氢离子浓度为10-12mol/L,水电离出来的氢离子和氢氧根离子浓度相等,故答案为:0.01 mol/L;10-12 mol/L;
(2)氢氧根离子浓度为0.01mol/L,则一水合氨的浓度远远大于0.01mol/L,盐酸浓度为0.01mol/L,氨水与盐酸完全中和,即一水合氨的物质的量与盐酸相同,盐酸体积大于氨水;氯化铵溶液因为铵根水解显酸性,离子方程式为:NH4++H2O?NH3?H2O+H+,pH<7;溶液显酸性c(H+)>c(OH-),依据电荷守恒其离子浓度的关系为,c(Cl-)>c(NH4+),所以离子浓度由大到小的关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:>;<;NH4++H2O?NH3?H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(3)氢离子与氢氧根离子浓度相同的氨水和盐酸混合,溶液显碱性,现溶液显中性,盐酸浓度应大于0.01mol/L,则pH<2;
中性溶液中利用电荷守恒判断离子浓度关系为c(NH4+)=c(Cl-)>c(OH-)=c(H+),故答案为:<;c(NH4+)=c(Cl-)>c(OH-)=c(H+).
(2)氢氧根离子浓度为0.01mol/L,则一水合氨的浓度远远大于0.01mol/L,盐酸浓度为0.01mol/L,氨水与盐酸完全中和,即一水合氨的物质的量与盐酸相同,盐酸体积大于氨水;氯化铵溶液因为铵根水解显酸性,离子方程式为:NH4++H2O?NH3?H2O+H+,pH<7;溶液显酸性c(H+)>c(OH-),依据电荷守恒其离子浓度的关系为,c(Cl-)>c(NH4+),所以离子浓度由大到小的关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:>;<;NH4++H2O?NH3?H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(3)氢离子与氢氧根离子浓度相同的氨水和盐酸混合,溶液显碱性,现溶液显中性,盐酸浓度应大于0.01mol/L,则pH<2;
中性溶液中利用电荷守恒判断离子浓度关系为c(NH4+)=c(Cl-)>c(OH-)=c(H+),故答案为:<;c(NH4+)=c(Cl-)>c(OH-)=c(H+).
点评:本题考查了弱电解质的电离平衡依据电离方程式书写,离子浓度大小比较,题目难度中等.

练习册系列答案
相关题目
下列图示与对应的叙述不相符的是( )
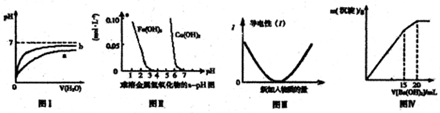

| A、图Ⅰ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线b对应的是盐酸 |
| B、根据图Ⅱ可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO2调节pH在4-5之间即可 |
| C、图Ⅲ可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 |
| D、图Ⅳ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mLBa(OH)2溶液时,沉淀全部是BaSO4 |
下列叙述错误的是( )
| A、乙烯和苯都能使溴水层颜色褪去,褪色的原理相同 |
| B、淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| C、煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
| D、乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
下列事实不能说明醋酸为弱酸的是( )
| A、稀醋酸溶液的导电性比较弱 |
| B、向CH3COONa溶液中滴入酚酞试液,溶液变红色 |
| C、一定温度下,向某醋酸溶液中加入CH3COONH4晶体,溶液pH增大 |
| D、一定温度下,向体积相同,pH值也相同的盐酸和醋酸中,投入相同质量的锌粒,锌粒完全溶解所消耗的时间不同 |
下列物质中,既能与NaOH溶液反应,又能与盐酸反应,还能发生水解反应的是( )
①AlCl3 ②NaHSO4 ③(NH4)2CO3 ④CH3COONa ⑤NaHCO3.
①AlCl3 ②NaHSO4 ③(NH4)2CO3 ④CH3COONa ⑤NaHCO3.
| A、①④⑤ | B、③⑤ | C、④⑤ | D、全部 |
已知甲为恒压容器、乙为恒容容器.相同条件下充入等物质的量的NO2气体,且起始时的体积相同.发生反应:2NO2?N2O4一段时间后相继达到平衡状态.下列说法正确的是( )
| A、平衡时NO2的体积分数:甲>乙 |
| B、达到平衡所需要时间,甲比乙多 |
| C、平衡时的颜色,甲比乙深 |
| D、平衡时的平均相对分子质量:甲<乙 |
下列说法或表示法错误的是( )
| A、化学反应过程中的能量变化除了热能外,还可以是光能、电能等 |
| B、放热反应的△H<0 |
| C、需要加热才能发生反应一定是吸热反应 |
| D、热化学方程式中的化学计量数仅表示该物质的物质的量,可以是分数 |
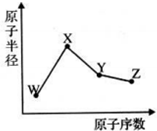 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强,下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强,下列说法正确的是( )| A、对应气态氢化物的稳定性Y>Z |
| B、化合物XZW既含离子键也含共价键 |
| C、对应简单离子半径W<X |
| D、Y的氧化物能与Z或X的最高价氧化物对应的水化物反应 |