题目内容
常温下,有物质的量浓度、体积都相同的NaA(pH=8)和NaB(pH=12)溶液,下列说法不正确的是( )
| A、NaB溶液比NaA溶液更能促进水的电离 |
| B、将两溶液混合,混合溶液中:c(Na+)+c(H+)=c(OH-)+c(A-)+c(B-) |
| C、NaA溶液中:c(Na+)-c(A-)=10-6mol/L |
| D、NaB溶液中:c(H+)+c(HB)=10-2mol/L |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:物质的量浓度、体积都相同的NaA(pH=8)和NaB(pH=12)溶液,说明HA和HB都是弱酸,据“越弱越水解”判断,HA的酸性比HB强,据此分析.
解答:
解:A、物质的量浓度、体积都相同NaA溶液不如NaB溶液水解程度大,说明NaB溶液比NaA溶液更能促进水的电离,故A正确;
B、依据电荷守恒,在NaA和NaB的混合溶液中存在c(Na+)+c(H+)=c(OH-)+c(A-)+c(B-),故B正确;
C、依据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(A-),c(Na+)-c(A-)=c(OH-)-c(H+),NaA溶液的pH为8,则c(H+)=10-8mol/L,c(OH-)=10-6mol/L,所以c(Na+)-c(A-)=10-6mol/L-10-8mol/L,故C错误;
D、依据质子守恒,在NaB溶液中c(H+)+c(HB)=c(OH-),溶液pH=12,则c(OH-)=10-2mol/L,故D正确;
故选C.
B、依据电荷守恒,在NaA和NaB的混合溶液中存在c(Na+)+c(H+)=c(OH-)+c(A-)+c(B-),故B正确;
C、依据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(A-),c(Na+)-c(A-)=c(OH-)-c(H+),NaA溶液的pH为8,则c(H+)=10-8mol/L,c(OH-)=10-6mol/L,所以c(Na+)-c(A-)=10-6mol/L-10-8mol/L,故C错误;
D、依据质子守恒,在NaB溶液中c(H+)+c(HB)=c(OH-),溶液pH=12,则c(OH-)=10-2mol/L,故D正确;
故选C.
点评:本题考查了盐类水解以及溶液中的物料守恒、电荷守恒、质子守恒等,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某同学在实验室进行了如图所示的实验,下列说法中错误的是( )

| A、利用过滤的方法,可将Z中固体与液体分离 |
| B、X、Z烧杯中分散质相同 |
| C、Y中反应的离子方程式为3CaCO3+2Fe3++3H2O=2Fe(OH)3+3 CO2↑+3 Ca2+ |
| D、Z中分散系能产生丁达尔效应 |
黄铜矿(CuFeS2)常用于提炼金属铜.黄铜矿焙烧过程中所发生的反应比较复杂,其中主要反应之一的化学方程式为2CuFeS2+O2═□+2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )
| A、方框中的物质应为Cu2S |
| B、该反应的部分产物可用于硫酸工业 |
| C、反应中SO2既是氧化产物又是还原产物 |
| D、反应中若有1 mol SO2生成,则一定有4 mol电子发生转移 |
下列图示与对应的叙述不相符的是( )
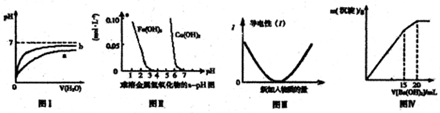

| A、图Ⅰ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线b对应的是盐酸 |
| B、根据图Ⅱ可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO2调节pH在4-5之间即可 |
| C、图Ⅲ可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 |
| D、图Ⅳ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mLBa(OH)2溶液时,沉淀全部是BaSO4 |
 经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )| A、该反应在T1、T3温度时达到化学平衡 |
| B、该反应在T1温度时达到化学平衡 |
| C、该反应为放热反应 |
| D、升高温度,平衡会向正反应方向移动 |
已知甲为恒压容器、乙为恒容容器.相同条件下充入等物质的量的NO2气体,且起始时的体积相同.发生反应:2NO2?N2O4一段时间后相继达到平衡状态.下列说法正确的是( )
| A、平衡时NO2的体积分数:甲>乙 |
| B、达到平衡所需要时间,甲比乙多 |
| C、平衡时的颜色,甲比乙深 |
| D、平衡时的平均相对分子质量:甲<乙 |
 我国著名化学家侯德榜先生发明的“侯氏制碱法”,因原料利用率高.并能进行连续生产,从而享誉中外.“侯氏制碱法”的基本做法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱.它的反应原理可用下列化学方程式表示:
我国著名化学家侯德榜先生发明的“侯氏制碱法”,因原料利用率高.并能进行连续生产,从而享誉中外.“侯氏制碱法”的基本做法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱.它的反应原理可用下列化学方程式表示: 近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致.钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致.钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3