题目内容
工业上生产MnO2和Zn的主要反应有:①MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O②MnSO4+ZnSO4+2H2O
MnO2+Zn+2H2SO4下列说法不正确的是( )
| ||
| A、①中MnO2和H2SO4都是氧化剂 |
| B、MnSO4的还原性小于Zn的还原性 |
| C、②中MnSO4发生氧化反应 |
| D、硫酸在该生产中可循环利用 |
考点:氧化还原反应
专题:
分析:从化合价的角度分析氧化还原反应,反应中,物质所含元素的化合价升高的物质为还原剂,降低的物质为氧化剂,反应中氧化剂和还原剂之间得失电子数目相等.
解答:
解:A.反应①中MnO2→MnSO4,Mn元素化合价降低,MnSO4为氧化剂,H2SO4起到酸性的作用,元素化合价没有发生变化,故A错误;
B.反应①中MnSO4为还原产物,Zn为还原剂,MnSO4的还原性小于Zn的还原性,故B正确;
C.②中MnSO4→MnO2,Mn元素化合价升高,发生氧化反应,故C正确;
D.反应①消耗硫酸,反应②生成硫酸,硫酸可循环利用,故D正确.
故选A.
B.反应①中MnSO4为还原产物,Zn为还原剂,MnSO4的还原性小于Zn的还原性,故B正确;
C.②中MnSO4→MnO2,Mn元素化合价升高,发生氧化反应,故C正确;
D.反应①消耗硫酸,反应②生成硫酸,硫酸可循环利用,故D正确.
故选A.
点评:本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,题目难度不大,本题注意从化合价变化的角度分析.

练习册系列答案
相关题目
下列各组溶液等体积混合后,所得溶液pH最大的是( )
| A、0.1mol?L-1NaHCO3溶液与0.1mol?L-1 NaOH溶液 |
| B、0.1mol?L-1NaHSO4溶液与0.1mol?L-1 Ba(OH)2溶液 |
| C、0.2mol?L-1氨水与0.1mol?L-1盐酸 |
| D、0.1mol?L-1氨水与0.1mol?L-1盐酸 |
黄铜矿(CuFeS2)常用于提炼金属铜.黄铜矿焙烧过程中所发生的反应比较复杂,其中主要反应之一的化学方程式为2CuFeS2+O2═□+2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )
| A、方框中的物质应为Cu2S |
| B、该反应的部分产物可用于硫酸工业 |
| C、反应中SO2既是氧化产物又是还原产物 |
| D、反应中若有1 mol SO2生成,则一定有4 mol电子发生转移 |
下列电解质溶液用惰性电极进行电解时,一段时间后,溶液的pH增大的是( )
| A、稀碳酸钠溶液 | B、硫酸钠溶液 |
| C、稀硫酸 | D、硫酸铜溶液 |
下列图示与对应的叙述不相符的是( )
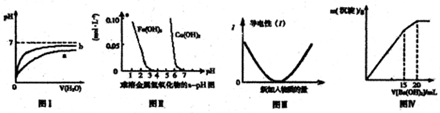

| A、图Ⅰ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线b对应的是盐酸 |
| B、根据图Ⅱ可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO2调节pH在4-5之间即可 |
| C、图Ⅲ可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 |
| D、图Ⅳ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mLBa(OH)2溶液时,沉淀全部是BaSO4 |
下列叙述错误的是( )
| A、乙烯和苯都能使溴水层颜色褪去,褪色的原理相同 |
| B、淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| C、煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
| D、乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |