题目内容
下列实验设计和结论相符的是( )
| A、测定中和热:取25 mL0.25 mol/L的硫酸溶液和25 mL0.5 mol/LNaOH溶液中和,测定反应放出的热 |
| B、在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 |
| C、将SO2与CO2的混合气通过品红溶液洗气后,可除去CO2中的SO2 |
| D、向含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2溶液,充分反应后过滤,可除去Ca(OH)2 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.浓硫酸、浓氢氧化钠稀释产生大量的热;
B.向FeCl3溶液中通足量Cl2后,可除去FeCl3溶液中的FeCl2杂质,但不能煮沸,煮沸会导致FeCl3水解;
C.品红溶液浓度很小,应用高锰酸钾溶液;
D.沉淀总是向更难溶的方向转化.
B.向FeCl3溶液中通足量Cl2后,可除去FeCl3溶液中的FeCl2杂质,但不能煮沸,煮沸会导致FeCl3水解;
C.品红溶液浓度很小,应用高锰酸钾溶液;
D.沉淀总是向更难溶的方向转化.
解答:
解:A.硫酸和氢氧化钠二者浓度太高,溶与水时都会放出大量热,故对中和热有影响,故A错误;
B.除去FeCl3溶液中混有的少量FeCl2,溶液中通入足量 Cl2后,反应为;2FeCl2+Cl2=2FeCl3,但不能煮沸,煮沸会导致FeCl3水解,最终生成氢氧化铁沉淀,得不到纯净的FeCl3溶液,故B错误;
C.品红溶液浓度很小,除掉二氧化硫应用高锰酸钾溶液,故C错误;
D.氢氧化镁难溶,氢氧化钙微溶,所以氢氧化钙可以与氯化镁反应生成氢氧化镁,然后过滤,就可以得到纯净的氢氧化镁,故D正确.
故选D.
B.除去FeCl3溶液中混有的少量FeCl2,溶液中通入足量 Cl2后,反应为;2FeCl2+Cl2=2FeCl3,但不能煮沸,煮沸会导致FeCl3水解,最终生成氢氧化铁沉淀,得不到纯净的FeCl3溶液,故B错误;
C.品红溶液浓度很小,除掉二氧化硫应用高锰酸钾溶液,故C错误;
D.氢氧化镁难溶,氢氧化钙微溶,所以氢氧化钙可以与氯化镁反应生成氢氧化镁,然后过滤,就可以得到纯净的氢氧化镁,故D正确.
故选D.
点评:本题考查较为综合,涉及中和热测定、物质分离提纯、沉淀转化等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.

练习册系列答案
相关题目
黄铜矿(CuFeS2)常用于提炼金属铜.黄铜矿焙烧过程中所发生的反应比较复杂,其中主要反应之一的化学方程式为2CuFeS2+O2═□+2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )
| A、方框中的物质应为Cu2S |
| B、该反应的部分产物可用于硫酸工业 |
| C、反应中SO2既是氧化产物又是还原产物 |
| D、反应中若有1 mol SO2生成,则一定有4 mol电子发生转移 |
下列电解质溶液用惰性电极进行电解时,一段时间后,溶液的pH增大的是( )
| A、稀碳酸钠溶液 | B、硫酸钠溶液 |
| C、稀硫酸 | D、硫酸铜溶液 |
下列图示与对应的叙述不相符的是( )
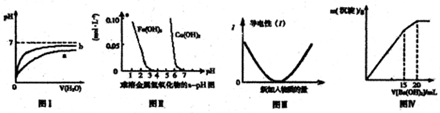

| A、图Ⅰ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线b对应的是盐酸 |
| B、根据图Ⅱ可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO2调节pH在4-5之间即可 |
| C、图Ⅲ可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 |
| D、图Ⅳ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mLBa(OH)2溶液时,沉淀全部是BaSO4 |
下列事实不能说明醋酸为弱酸的是( )
| A、稀醋酸溶液的导电性比较弱 |
| B、向CH3COONa溶液中滴入酚酞试液,溶液变红色 |
| C、一定温度下,向某醋酸溶液中加入CH3COONH4晶体,溶液pH增大 |
| D、一定温度下,向体积相同,pH值也相同的盐酸和醋酸中,投入相同质量的锌粒,锌粒完全溶解所消耗的时间不同 |

 我国著名化学家侯德榜先生发明的“侯氏制碱法”,因原料利用率高.并能进行连续生产,从而享誉中外.“侯氏制碱法”的基本做法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱.它的反应原理可用下列化学方程式表示:
我国著名化学家侯德榜先生发明的“侯氏制碱法”,因原料利用率高.并能进行连续生产,从而享誉中外.“侯氏制碱法”的基本做法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱.它的反应原理可用下列化学方程式表示: 近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致.钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致.钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3