题目内容
在t℃时,10mL 0.4mol?L-1 H2O2溶液发生催化分解:2H2O2═2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表
下列叙述不正确的是(溶液体积变化忽略不计)( )
| t/min | 0 | 2 | 4 | 6 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 |
| A、0~2min H2O2平均反应速率比4~6min快 |
| B、0~6min的平均反应速率v(H2O2)≈3.3×10-2mol?L-1?min-1 |
| C、反应至6min时,c(H2O2)═0.3mol?L-1 |
| D、反应至6min时,H2O2分解了50% |
考点:化学平衡的计算
专题:化学平衡专题
分析:根据化学反应速率之比等化学计量数之比进行计算,根据化学反应速率的定义进行计算,得出正确结论,化学反应速率v=
计算.
| △c |
| △t |
解答:
解:2H2O2═2H2O+O2↑,
A.0~2min产生的氧气的物质的量n(O2)=
=0.00044mol,n(H202)=2n(O2)=0.00088mol,v(H202)=
≈4.4×10-2mol/(L?min),4~6min产生的氧气的物质的量n(O2)=
=2.3×10-4mol,n(H202)=2n(O2)=4.6×10-4mol,
=2.3×10-2mol/L?min,0~2min H2O2平均反应速率比4~6min快,故A正确;
B.A.0~6min产生的氧气的物质的量n(O2)=
=0.001mol,n(H202)=2n(O2)=0.002mol,v(H202)=
≈3.3×10-2mol/(L?min),故B正确;
C.6min时,c(H2O2)=0.40-
=0.20mol/L,故C错误;
D.6min时,H2O2分解的分解率为:
×100%=50%,故D正确,
故选C.
A.0~2min产生的氧气的物质的量n(O2)=
| 9.9×10-3L |
| 22.4L/mol |
| ||
| 2min |
| (22.4-17.2)×10-3L |
| 22.4L/mol |
| ||
| 2min |
B.A.0~6min产生的氧气的物质的量n(O2)=
| 22.4×10-3L |
| 22.4L/mol |
| ||
| 6 |
C.6min时,c(H2O2)=0.40-
| 0.002 |
| 0.01 |
D.6min时,H2O2分解的分解率为:
| 0.20 |
| 0.40 |
故选C.
点评:本题考查化学反应速率的相关计算,把握化学反应速率之比等化学计量数之比为解答的关键,难度不大.

练习册系列答案
相关题目
将钠加入到下列溶液中,既产生气体又产生沉淀的是( )
| A、CuCl2 |
| B、Na2SO4 |
| C、MgCl2 |
| D、KNO3 |
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温下,23g NO2 含有nA个氧原子 |
| B、0.1mol/L NaCl溶液含有0.1nA个Cl- |
| C、常温常压下,22.4L CCl4含有nA个CCl4分子 |
| D、含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1mol/L |
在一定温度下,反应:2A(s)+2B(g)?C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( )
| A、混合气的密度不再随时间而变化 |
| B、C的质量不再改变 |
| C、容器内的压强不随时间而变化 |
| D、单位时间内生成2a mol B,同时生成a molD |
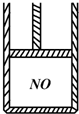 如图为装有活塞(质量忽略不计)的密闭容器,内盛22.4mL一氧化氮,若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度压强不变,则容器内的密度为(提示:不考虑NO转化为NO2的可逆性)( )
如图为装有活塞(质量忽略不计)的密闭容器,内盛22.4mL一氧化氮,若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度压强不变,则容器内的密度为(提示:不考虑NO转化为NO2的可逆性)( )| A、等于1.369g?L-1 |
| B、等于2.054g?L-1 |
| C、在1.369g?L-1和2.054g?L-1之间 |
| D、在2.054g?L-1和4.108g?L-1之间 |
下列反应离子方程式正确的是( )
| A、FeCl3 溶液刻蚀铜制的印刷电路板:Fe3++Cu=Fe2++Cu2+ |
| B、硅酸钠溶液和稀硫酸混合:Na2SiO3+2H+=H2SiO3↓+2Na+ |
| C、Ba(OH)2 溶液与稀硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、向氯化铝溶液中滴加过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
下列能达到实验目的是( )
A、 除去Fe(OH)3胶体中的FeCl3 |
B、 干燥、收集氨气,并吸收多余的氨气 |
C、 分离乙醇、乙酸 |
D、 除去杂质气体二氧化碳 |
已知BrCl能发生下列反应:nBrCl+2M=MCln+MBrn(M为+n价的金属元素),BrCI+H20=HCl+HBrO,以下推论正确的是( )
| A、BrCl具有和卤素单质相似的化学性质 |
| B、BrCl和M反应时,BrCl即为氧化剂又为还原剂 |
| C、BrCl和NaOH溶液反应生成NaCI、NaBrO两种盐 |
| D、将BrCl跟FeS04溶液反应.溶液会变成无色 |