题目内容
已知BrCl能发生下列反应:nBrCl+2M=MCln+MBrn(M为+n价的金属元素),BrCI+H20=HCl+HBrO,以下推论正确的是( )
| A、BrCl具有和卤素单质相似的化学性质 |
| B、BrCl和M反应时,BrCl即为氧化剂又为还原剂 |
| C、BrCl和NaOH溶液反应生成NaCI、NaBrO两种盐 |
| D、将BrCl跟FeS04溶液反应.溶液会变成无色 |
考点:氯、溴、碘及其化合物的综合应用
专题:卤族元素
分析:BrCl中Br为+价,Cl为-1价,由nBrCl+2M=MCln+MBrn可知,BrCl具有强氧化性,具有卤素单质的性质,反应BrCl+H2O=HCl+HBrO中,元素的化合价没有发生变化,为水解反应,以此解答该题.
解答:
解:A.根据题中信息,BrCl能与金属、水反应,其性质与卤素的单质相似,故A正确;
B.BrCl和M反应时,Br元素化合价降低,Cl元素化合价不变,BrCl只做氧化剂,故B错误;
C.由BrCl与水反应的特点可知BrCl+2NaOH=NaCl+NaBrO+H2O,故C错误;
D.BrCl的氧化性介于氯与溴之间,跟FeSO4溶液反应,会把Fe2+氧化成Fe3+,故D错误.
故选A.
B.BrCl和M反应时,Br元素化合价降低,Cl元素化合价不变,BrCl只做氧化剂,故B错误;
C.由BrCl与水反应的特点可知BrCl+2NaOH=NaCl+NaBrO+H2O,故C错误;
D.BrCl的氧化性介于氯与溴之间,跟FeSO4溶液反应,会把Fe2+氧化成Fe3+,故D错误.
故选A.
点评:本题考查卤素互化物的知识,侧重于学生自学能力、分析能力和综合运用化学知识的考查,为高考常见题型,难度不大,注意从化合价的角度解答该题.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
在t℃时,10mL 0.4mol?L-1 H2O2溶液发生催化分解:2H2O2═2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表
下列叙述不正确的是(溶液体积变化忽略不计)( )
| t/min | 0 | 2 | 4 | 6 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 |
| A、0~2min H2O2平均反应速率比4~6min快 |
| B、0~6min的平均反应速率v(H2O2)≈3.3×10-2mol?L-1?min-1 |
| C、反应至6min时,c(H2O2)═0.3mol?L-1 |
| D、反应至6min时,H2O2分解了50% |
下列有关实验现象与其它三项不同的是( )
| A、向BaCl2溶液中通入少量CO2 |
| B、向饱和Na2CO3溶液中通CO2 |
| C、向Ba(OH)2溶液中滴加K2SO4溶液 |
| D、向Ca(OH)2溶液中通入少量CO2 |
下列事实与氢键有关的是( )
| A、水加热到很高温度都难以分解 |
| B、水结成冰体积膨胀,密度变小 |
| C、CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
| D、NH3的热稳定性比PH3强 |
下列有关金属的说法正确的是( )
| A、金属原子只有还原性,金属阳离子只有氧化性 |
| B、金属单质在常温下都是固体 |
| C、金属阳离子被还原不一定得到金属单质 |
| D、含金属元素的离子都是阳离子 |
“群众利益无小事,食品安全是大事”下列会导致食品对人体健康有害的做法是( )
| A、用蔗糖做食品的甜味剂 |
| B、用甲醛侵泡水产品 |
| C、用干冰保存易腐败的食品 |
| D、用袋装生石灰做饼干类食品的干燥剂 |
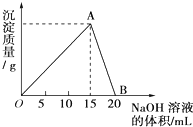 向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示: