题目内容
9.(1)100mL0.25mol•L-1BaCl2溶液中,Cl-物质的量浓度为0.5mol/L,若将上述溶液中的Ba2+恰好完全沉淀,需要物质的量浓度为1.00mol•L-1的稀硫酸25mL.(2)标状况下,等质量的下列气体所占有的体积最大的是②.①O2②CH4③CO2④SO2.
(3)实验室制备氯气的化学方程式MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,在该反应中氧化剂是MnO2,氧化剂和还原剂的物质的量之比为1:2,产生标准状况下33.6LCl2时,转移电子的物质的量为3mol.
分析 (1)溶液中离子的浓度=电解质的浓度×一个分子中含有的离子数目;将溶液中的Ba2+恰好完全沉淀,则n(H2SO4)=n(BaSO4)=n(BaCl2),再根V=$\frac{n}{c}$计算需要硫酸的体积;
(2)根据V=nVm=$\frac{m}{M}$Vm可知:相同条件下,相等质量的气体,其摩尔质量越小占有的体积越大;
(3)实验室利用二氧化锰做氧化剂和还原剂浓盐酸加热反应生成二氧化锰、氯气和水;氧化剂是二氧化锰,还原剂是盐酸,两者物质的量之比为:1:2;产生标准状况下33.6LCl2即1.5mol,转移电子为3mol.
解答 解:(1)100ml0.25mol.L-1BaCl2溶液中,Cl-的物质的量浓度为c(Cl-)=2c(BaCl2)=2×0.25mol/L=0.5mol/L;,将溶液中的Ba2+恰好完全沉淀,则n(H2SO4)=n(BaSO4)=n(BaCl2)=0.1L×0.25mol/L=0.025mol,需要硫酸的体积为$\frac{0.025mol}{1mol/L}$=0.025L=25mL,故答案为:0.5mol/L;25;
(2)根据V=nVm=$\frac{m}{M}$Vm可知:相同条件下,相等质量的气体,其摩尔质量越小占有的体积越大,由于摩尔质量:SO2>CO2>O2>CH4,故甲烷的体积最大,
故答案为:②;
(3)实验室利用二氧化锰做氧化剂和还原剂浓盐酸加热反应生成二氧化锰、氯气和水,反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,氧化剂是二氧化锰,还原剂是盐酸,两者物质的量之比为:1:2;产生标准状况下33.6LCl2即1.5mol,转移电子为3mol,故答案为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;MnO2; 1:2; 3mol.
点评 本题考查物质的量有关计算、氧化物的分类等,比较基础,注意对基础知识的理解掌握.

 考前必练系列答案
考前必练系列答案| A. | 2,2-甲基-3-乙基丁烷 | B. | 2-甲基-3-乙基戊烷 | ||
| C. | 3-甲基-2-乙基戊烷 | D. | 2,3,4-3甲基丁烷 |
| A. | 用过量氨水吸收SO2:NH3•H2O+SO2═NH4++HSO3- | |
| B. | 铁和稀硝酸反应后,溶液pH=2 Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 用石灰水处理含有Mg2+和HCO3-的硬水,发生反应的离子方程式为Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O | |
| D. | 向银氨溶液中加入盐酸[Ag(NH3)2]++OH-+3H+═Ag++2NH4++H2O |
| A. | 左盘下沉 | B. | 右盘下沉 | C. | 仍保持平衡 | D. | 无法判断 |
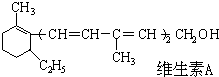
| A. | 维生素A的一个分子中有五个双键 | |
| B. | 维生素A的一个分子中有30个氢原子 | |
| C. | 维生素A能使溴水褪色,能被酸性KMnO4氧化 | |
| D. | 维生素A是一种烯烃 |
| A. | 向0.1mol/L的NaOH溶液中加入等体积的0.1mol/L的HCl溶液 | |
| B. | 向0.1mol/L的NaOH溶液中加入等体积的0.1mol/L的CH3COOH溶液 | |
| C. | 向0.1mol/L的Ba(OH)2溶液中加入等体积的0.1mol/L的H2SO4溶液 | |
| D. | 向0.1mol/L的NH3•H2O溶液中加入等体积的0.1mol/L的CH3COOH溶液 |
| A. | 3p2表示3p能级有两个轨道 | B. | 原子晶体中可能存在离子键 | ||
| C. | 分子晶体中一定存在共价键 | D. | sp2杂化轨道模型为 |
| A. | 0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>c(OH-)>cCH3COO-) | |
| B. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |