题目内容
12.某有机物H(C19H20O4)是塑料工业主要的增塑剂,其合成方法如图:
已知:①
 ②反应F→G仅发生中和反应
②反应F→G仅发生中和反应回答下列问题:
(1)A的名称为甲苯,C、F生成H的反应类型为酯化反应.
(2)B→C的化学方程式为
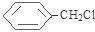 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$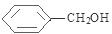 +NaCl.
+NaCl.(3)F的结构简式为
 .
.(4)G+B→H的化学方程式为
 .
.(5)D的二氯代物有10种,其核磁共振氢谱只有6组峰的结构简式为
 中任一种(写出一种即可).
中任一种(写出一种即可).
分析 由合成图C的结构简式 可知,反应A→B为取代反应,B→C为卤代烃的水解反应,则A为
可知,反应A→B为取代反应,B→C为卤代烃的水解反应,则A为 ,B为
,B为 ;又由合成图及信息①可知,反应E→F为信息①的取代反应,则F为
;又由合成图及信息①可知,反应E→F为信息①的取代反应,则F为 ,F与NaOH溶液发生中和反应生成G,G为
,F与NaOH溶液发生中和反应生成G,G为 ;C与F发生的酯化反应生成H,则H为
;C与F发生的酯化反应生成H,则H为 ,G和B发生取代反应也生成H,以此来解答.
,G和B发生取代反应也生成H,以此来解答.
解答 解:(1)根据以上分析,A为 ,名称为甲苯,C与F发生的酯化反应生成H,故答案为:甲苯;酯化反应;
,名称为甲苯,C与F发生的酯化反应生成H,故答案为:甲苯;酯化反应;
(2)根据以上分析,B→C为卤代烃的水解反应,则化学方程式为 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl,故答案为:
+NaCl,故答案为: +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl;
+NaCl;
(3)根据以上分析,F的结构简式为 ,故答案为:
,故答案为: ;
;
(4)G+B→H的化学方程式为 ,故答案为:
,故答案为: ;
;
(5)萘是高度对称的结构,上下、左右对称, 共有2种氢原子,则其一氯代物有2种(
共有2种氢原子,则其一氯代物有2种( ),二氯代物有10种(
),二氯代物有10种( ,则核磁共振氢谱只有6组峰的结构简式为
,则核磁共振氢谱只有6组峰的结构简式为 中任一种,
中任一种,
故答案为:10; 中任一种.
中任一种.
点评 本题考查有机物的合成,明确合成图中各物质是解答本题的关键,注意反应条件及物质的官能团、碳链结构等的变化即可解答,题目难度中等.

练习册系列答案
相关题目
20.碱性锌锰电池比酸性锌猛电池性能好,放电电流大,碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,下列有关碱性锌锰电池的说法正确的是( )
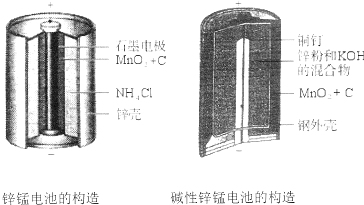

| A. | 该电池反应中二氧化锰起催化作用 | |
| B. | 电池负极反应式为:2MnO2+2e-+2H2O═2MnOOH+2OH- | |
| C. | 当0.1molZn完全反应时,流经电池内部的电子个数为1.204×1023 | |
| D. | 碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大 |
7.下列说法正确的是( )
| A. | 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 | |
| B. | 碘易升华,可用加热升华法除去NH4Cl混有的I2 | |
| C. | 铁在硫蒸气中燃烧生成Fe2S3 | |
| D. | 在过氧化钠与水的反应,毎生成0.1mol氧气,转移电子的数目为0.2NA |
17.利用如图所示装置可以将温室气体CO2转化为燃料气体CO.下列说法中,正确的是( )

| A. | 该过程是将太阳能转化为化学能的过程 | |
| B. | 电极a表面发生还原反应 | |
| C. | 该装置工作时,H+从b极区向a极区移动 | |
| D. | 该装置中每生成1 mol CO,同时生成1 mol O2 |
4.为了从海带浸取液中提取碘,某同学设计了如图实验方案:下列说法正确的是( )


| A. | ①中反应的离子方程式:2I-+H2O2═I2+2OH- | |
| B. | ②中分液时含I2的CCl4溶液从分液漏斗上口倒出 | |
| C. | ③中得到的上层溶液中含有I- | |
| D. | 操作Z的名称是加热 |
1.下列存放物质的方法中不正确的是( )
| A. | 金属钠保存在煤油中 | |
| B. | 氢氟酸保存在玻璃试剂瓶中 | |
| C. | 漂白粉必须密封保存 | |
| D. | 氢氧化钠溶液保存在带橡胶塞的试剂瓶中 |
2.N2(g)与H2(g)在铁催化剂表面经历如图过程生成NH3(g):下列说法不正确的是( )
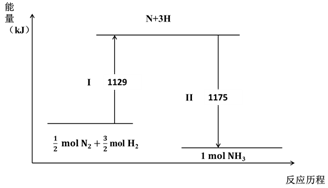

| A. | Ⅰ过程中破坏的均为非极性键 | |
| B. | Ⅰ过程吸收能量,II过程放出能量 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H=-44 kJ•mol-1 | |
| D. | 1mol N2(g)与3 mol H2(g)所具有的总能量比2 mol NH3(g) 所具有的总能量高 |



