题目内容
2.N2(g)与H2(g)在铁催化剂表面经历如图过程生成NH3(g):下列说法不正确的是( )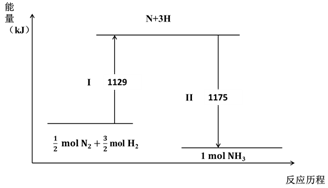
| A. | Ⅰ过程中破坏的均为非极性键 | |
| B. | Ⅰ过程吸收能量,II过程放出能量 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H=-44 kJ•mol-1 | |
| D. | 1mol N2(g)与3 mol H2(g)所具有的总能量比2 mol NH3(g) 所具有的总能量高 |
分析 由图象可知反应物总能量大于生成物总能量,为放热过程,且Ⅰ为共价键的断裂、Ⅱ为共价键的形成,以此解答该题.
解答 解:A.Ⅰ为共价键的断裂,氮气、氢气存在非极性键,故A正确;
B.断裂化学键吸收能量,形成化学键放出能量,故B正确;
C.由图象可知N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1,故C错误;
D.由图象可知反应物总能量大于生成物总能量,为放热过程,故D正确.
故选C.
点评 本题考查了化学反应能量变化,图象分析判断,为高频考点,侧重考查学生的分析能力,注意拆化学键吸收能量,形成化学键放出能量,题目难度中等.

练习册系列答案
相关题目
13.设NA 表示阿伏加德罗常数值.下列说法正确的是( )
| A. | 标准状况下,11.2 L的甲醇所含的氢原子数等于2NA | |
| B. | 常温下,Na2O2与H2O反应生成1mol O2时,转移电子数是2NA | |
| C. | 标准状况下,2.24 LCl2溶于水中达到饱和,可得到HClO分子的数目是0.1NA | |
| D. | 1L 1 mol/L CuCl2溶液中含有的铜离子数为NA |
10.下列关于化学反应速率的说法中,不正确的是( )
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 反应速率越大,反应现象就一定越明显 | |
| D. | 增大反应物的浓度、提高反应温度都能增大反应速率 |
17.下列物质间的转化不能通过一步反应实现的是( )
| A. | SiO2→H2SiO3 | B. | HClO→O2 | C. | Fe→FeCl2 | D. | Cu→CuSO4 |
7.下列说法正确的是( )
| A. | 用试管夹夹试管应从试管底往上套,拇指按在试管夹的短柄上 | |
| B. | 装碘的试剂瓶中残留的碘可以用酒精洗涤 | |
| C. | 配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用滴管滴加蒸馏水到刻度线 | |
| D. | 定容时,俯视刻度线,会使所配溶液的浓度偏低 |
11.下列关于官能团的判断中说法不正确的是( )
| A. | 醇的官能团是羟基(-OH) | B. | 酚的官能团是羟基(-OH) | ||
| C. | 醛的官能团是醛基(-CHO) | D. | 羧酸的官能团是羟基(-OH) |
17.下列实验装置选择正确,能达到目的是( )
| A. | 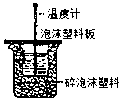 测定酸碱反应中和热 | B. | 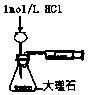 测定反应速率 | ||
| C. | 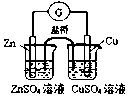 实现化学能转换为电能 | D. | 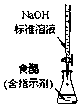 测定食醋浓度 |

 ②反应F→G仅发生中和反应
②反应F→G仅发生中和反应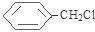 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$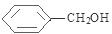 +NaCl.
+NaCl. .
. .
. 中任一种(写出一种即可).
中任一种(写出一种即可).